Cursos
← vista completaPublicado el 1 de agosto de 2004 | http://doi.org/10.5867/medwave.2004.07.3613
Mecanismos de acción e impacto en la práctica clínica de la resistencia a los medicamentos antifúngicos
Mechanisms of action and impact on clinical practice of antifungal drug resistance
Resumen
Este texto completo es la transcripción editada y revisada del Curso de Inmersión en Micosis Invasiva, organizado en Santiago por Merck, Sharp & Dohme durante los días 1 y 2 de julio de 2003.
La definición de laboratorio de la actividad fungicida es la reducción de 99,9% en las unidades formadoras de colonias. Este es el criterio que se usa para bacterias y algunos lo utilizan para los hongos. En mi opinión no es una definición muy útil. Según este criterio, el laboratorio informa, por ejemplo, que la caspofungina es fungicida. Sin embargo, al tratar con el presunto fungicida a pacientes que tienen, por ejemplo, coccidioidomicosis o criptococosis, muchos de ellos recaen o mueren. Por lo tanto, en mi definición, como clínico, el mejor agente fungicida es aquel que no deja ninguna célula fúngica viva en el paciente.
Además, debe ser hidrosoluble y debe poder administrarse por vía oral o intravenosa. Los mejores agentes fungicidas disponibles actualmente en la clínica, la caspofungina y la anfotericina B, no existen en formulación oral, aunque la caspofungina es hidrosoluble.
Debe tener excelente distribución tisular, inclusive al sistema nervioso central. Esto no se cumple muy bien, ni con la anfotericina B ni con algunos otros fármacos.
Debe tener muy poca toxicidad. La anfotericina B, los triazoles de amplio espectro y otros dan muchos problemas en este sentido.
Debe tener muy pocas interacciones con otros fármacos. Sabemos los problemas del itraconazol y otros agentes relacionados.
Debe tener excreción lineal, básicamente renal, y debe permitir la administración una sola vez al día. Este requisito elimina la mayoría, excepto flucitosina y fluconazol
Debe tener un espectro amplio contra la mayoría de los hongos. Sería maravilloso tener un agente así, pero, en realidad, con disponer de uno que actúe contra todas las Candida y Aspergillus, y otros especiales que actúen sobre los demás, sería suficiente.
Si tuviéramos ese agente, debe matar todas las células fúngicas presentes en todos los sitios comprometidos de todos nuestros pacientes. Necesitamos que las mate a todas. No el 99,9%, queremos que mate el 100%. Eso es lo que no tenemos; no tenemos ningún fármaco antifúngico. Así que agradezco la ayuda del laboratorio, pero sigo viendo morir a mis pacientes tratados con agentes fungicidas. Lo que quiero tener es un agente antifúngico que sea como la penicilina, o como solía ser, para el Streptococcus pneumoniae.
Además, necesito que el agente mate rápidamente los hongos, en pocos minutos, y que actúe de igual manera en el individuo inmunocompetente y en el inmunodeprimido. Y no lo tenemos, lamentablemente.
¿De que disponemos en la práctica ? La tabla I resume la solubilidad, distribución tisular y demás características que algunos de los agentes sí tienen y se observa que, según mi definición inicial, ninguno de ellos es realmente fungicida.
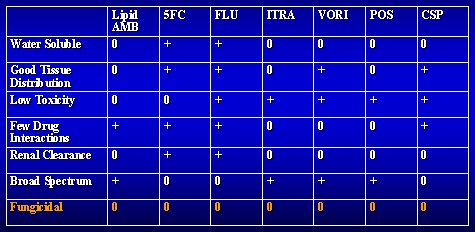 Tamaño completo
Tamaño completo Tabla I. Características farmacológicas de algunos agentes antifúngicos.
Volviendo a la definición de laboratorio, un agente fungistático es el que reduce el crecimiento del hongo. Esto se mide por la menor concentración de la droga por tubo de medio de cultivo o por un cierto diámetro de difusión en caso de discos, o por cambios en el color del Azul Alamar, o por una disminución previamente establecida de la turbidez en un cultivo en caldo . Es lo que conocemos como la Concentración Inhibitoria Mínima o MIC. Según este criterio, el fluconazol es fungistático. No mata, pero inhibe el crecimiento.
El concepto de fungicida en laboratorio se refiere al agente que disminuye en 99,9% las colonias a partir de un inóculo de subcultivo puro, expresado habitualmente como MFC o Concentración Fungicida Mínima. Con este criterio, la caspofungina y la anfotericina B son fungicidas para Candida.
Ahora tenemos una definición nueva, que se conoce como Concentración Efectiva Mínima. Es la concentración mínima del agente que produce cambio en la morfología del hongo. Se lee con hongos micelares y se desarrolló con caspofungina, porque ésta, en realidad, no mata a todos los Aspergillus, Coccidioidomyces y otros; pero los inhibe o altera, lo que se puede observar en los cambios morfológicos. Por eso, se la considera fungistática para hongos filamentosos, aunque es fungicida contra Candida.
El gráfico siguiente (Figura 1) muestra el efecto post antifúngico (PAE), que es lo mismo que el efecto post antibacteriano. Se observa como el inóculo control crece hasta el punto de equilibrio; en cambio, en el hongo, al ser expuesto por un tiempo a fluconazol, el crecimiento disminuye, pero, si se retira el agente, el hongo recupera su crecimiento normal y a las pocas horas alcanza el tamaño del control. La diferencia en el tiempo de inhibición del crecimiento que se observa entre el fluconazol y la anfotericina B o la caspofungina es la diferencia entre los fungistáticos y los fungicidas. Con el agente fungicida el hongo demora mucho más en reiniciar el crecimiento. Por supuesto que el ideal sería un agente que mantuviera la curva siempre por debajo de la línea del 0, ya que eso sería un verdadero efecto fungicida. Es cierto que la anfotericina B mata a gran número de especies de Candida y la curva de crecimiento del hongo nunca se recupera, pero es cierto también que algunas especies de Candida se comportan como las del gráfico y, después de un tiempo, comienzan nuevamente a crecer, incluso en presencia de anfotericina B. Así, la anfotericina B no es totalmente fungicida contra todas las especies de Candida.
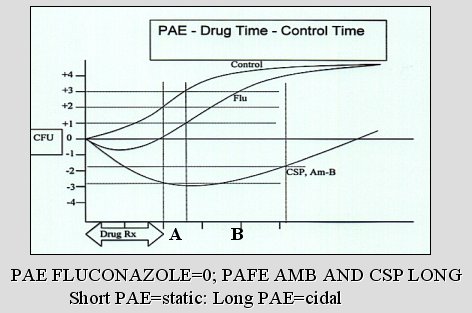 Tamaño completo
Tamaño completo Figura 1. Efecto post antifúngico.
Ahora quiero alejarme del laboratorio para acercarme a la cama del enfermo y analizar algunas correlaciones clínicas con la resistencia.
¿Qué es la resistencia? Retts acuñó el término S-DD (Susceptibilidad Dosis Dependiente). Yo no creo en eso, pero está definido para el fluconazol. En el tratamiento de la candidiasis mucosa, la eficacia depende de la relación MIC/AUC (concentración inhibitoria mínima dividida por el área bajo la curva). Para el fluconazol, el número de AUC es casi igual a la dosis diaria en miligramos de fluconazol. Es muy cómodo y fácil de usar. Si se puede lograr una relación de 25 o más, sería muy bueno en los casos de algorra o esofagitis.
La definición “S” significa susceptible. Si el MIC de fluconazol es igual a 8 microg/ml o menor, la relación de 25 se logra con alrededor de 200 mg/día, lo que da una respuesta clínica cercana a 90%, muy buena.
“S-DD” significa susceptibilidad dosis dependiente. Para mí, es lo mismo que susceptibilidad intermedia. Si el MIC del fluconazol está entre 16 y 32 ug/ml, es posible que se necesiten dosis hasta de 800 mg/día. Los estudios clínicos de esofagitis y algorra han demostrado que en esos casos la respuesta con 200 mg/día no supera 60%–70 %.
“R” significa resistencia. Si el MIC es superior a 64 microg/ml, es muy difícil lograr una relación MIC/AUC superior a 25. Hay resistencia y la respuesta clínica será menor de 70%.
Es exactamente lo mismo que con los antibacterianos. Craig, años atrás, y otros después, demostraron que si se trata con el antibiótico equivocado, al cual la bacteria es resistente, 30% a 40% de los pacientes probablemente respondan bien; si el agente tiene susceptibilidad intermedia, responderán entre 60 a 65% de los pacientes; y si se usa un agente muy bueno, al cual el organismo es susceptible, habrá respuesta en más de 90% de los casos. La respuesta depende de factores del huésped y otros factores. Pero hay una correlación. No significa que todo paciente tratado con fluconazol que está infectado por un hongo resistente al fluconazol, necesariamente vaya a morir por su infección. El rango de respuesta no es 0 a 100, sino que va de alrededor de 30 ó 40 a alrededor de 90%.
Es interesante observar que, con el itraconazol, el MIC para “S” es igual a 0,125 o menos; para “S-DD” está entre 0,25 y 0,5; y para “R” es igual a 0,5 o superior. ¿Por qué? La diferencia se debe a que la relación se establece con la concentración de agente libre en la sangre. Muchos de los antifúngicos, igual que los antibacterianos, se unen a proteínas; pero no más de 20% del fluconazol se une a proteínas, lo mismo que 95% o más del itraconazol y del posaconazol. Por eso es previsible que las concentraciones de susceptibilidad sean muy bajas para estos agentes. El voriconazol se une a proteínas en un 60%, y es muy difícil establecer la concentración de susceptibilidad o de resistencia con este antifúngico, pero está claro que, con el itraconazol y el posaconazol, las concentraciones que se manejan en el laboratorio para establecer la resistencia son muy bajas.
Hay muchos estudios sobre correlación de respuesta clínica y sensibilidad en laboratorio, pero se debe tener precaución al interpretarlos, porque en la mayoría el número de cepas S-DD o R es muy pequeño. Obviamente, en todos se observa la tendencia a un menor número de curaciones cuando el número de cepas resistentes aisladas es mayor.
Antes de la aparición de la terapia HAART, el SIDA plantea otra situación. Los pacientes VIH con recuentos de CD4 muy bajos y algorra que reciben fluconazol por un tiempo relativamente prolongado, desarrollaban Candida albicans resistente y aumentaba el número de fracasos clínicos. La Candida no albicans rara vez produce enfermedad; ocasionalmente, C. glabrata, pero en general es muy raro. Actualmente, en los Estados Unidos y también en Chile, tenemos la terapia anti VIH, por lo que casi no hay casos tratados por largo tiempo con fluconazol, y el problema de la resistencia de C. albicans es realmente mínimo. Pero esto no es así en extensas regiones, por ejemplo, de África o India, donde nos enfrentamos al problema de las Candida resistentes en la candidiasis mucosa asociada con VIH.
La tabla II presenta un resumen de la sensibilidad de las especies de Candida que producen enfermedad sistémica, es decir, que entran al torrente sanguíneo. Lo más evidente es que casi todas las especies resistentes aisladas de sangre corresponden a Candida no albicans.
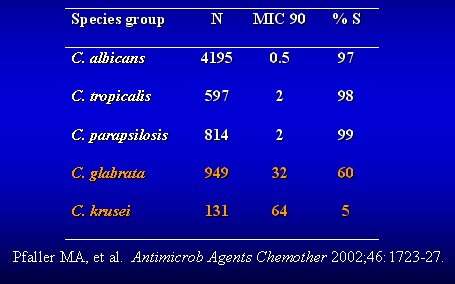 Tamaño completo
Tamaño completo Tabla II. Actividad de fluconazol contra Candida.
Se ve que la sensibilidad de las C. albicans es de 97%. La C. tropicalis, en nuestro medio, tiene una excelente sensibilidad, igual que la C.parapsilosis. La sensibilidad de C. kruzei es sólo de 5% y hay discusión sobre lo que ocurre con C. glabrata, porque la mayoría de ellas aparecen como de sensibilidad intermedia. No estoy muy seguro de que la cifra de 60% de sensibilidad sea realmente sensibilidad, porque la mayoría de los estudios de correlación clínica se hicieron en casos de algorra y esofagitis, y es poco lo que se ha hecho con hemocultivos. Es algo que sigue preocupándome.
La razón es que hay muchos mecanismos de resistencia al fluconazol. Perea publicó en el CID 35:1073,2002, un estudio en el cual buscaba el mecanismo de resistencia en todas las cepas resistentes que se aislaban.
El primer concepto que aparece es el de las bombas de exportación multidrogas (MDR). Su función no es librarse del fluconazol; ellas cumplen muchas funciones de la célula fúngica, una de las cuales, desde el punto de vista del hongo, es librarse del fluconazol o de los demás triazoles.
El mecanismo de resistencia MDR es bastante específico para el fluconazol, por lo que en los hongos que desarrollan este mecanismo, el itraconazol, posaconazol u otros triazoles podrían ser eficaces.
Por otra parte, el mecanismo de resistencia CDR es más amplio y confiere resistencia a un gran número de agentes. Así un hongo que desarrolla resistencia al itraconazol, por medio de una bomba CDR, será también resistente al voriconazol y probablemente a todos los nuevos triazoles . Este es el problema que se plantea al tratar Candida con los nuevos triazoles. Si la Candida es sensible al fluconazol, lo será también a todos los otros triazoles, por lo que no tiene sentido gastar más en agentes más caros. Si se hace resistente por mecanismo MDR, aún puede ser sensible a los triazoles nuevos; pero, por desgracia, alrededor de la mitad de los casos de resistencia se deben a mecanismo CDR. Es decir, o bien se debe determinar el mecanismo de la resistencia, lo que exige técnicas moleculares, o bien se debe tener mucho cuidado al indicar posa o voriconazol, u otro triazol nuevo, en los casos de Candida resistente al fluconazol, especialmente cuando hay fungemia y el paciente está muy grave, porque podrían ser inútiles.
El otro mecanismo de resistencia es el aumento de síntesis de una molécula blanco, lo que en este caso significa un aumento en la síntesis de inosterol dimetilasa. Es el que explica, probablemente, que podamos usar dosis más altas de fluconazol para alcanzar la relación MIC/AUC de 25 en presencia de un MIC de 16 a 32.
Cómo último mecanismo de resistencia, la mutación en la molécula blanco, aunque es poco frecuente, es muy difícil de predecir, es aleatoria y sigue siendo muy problemática.
En resumen, la mitad de las Candida resistentes al fluconazol pueden ser sensibles a los nuevos triazoles, pero eso depende del mecanismo de resistencia. Al respecto, los mejores datos disponibles se refieren a esofagitis por C. albicans; hay pocos datos en candidemia, donde el causante no es C. albicans sino C. glabrata.
Un problema agregado es que la resistencia no se debe forzosamente a un solo mecanismo. Como lo demuestra Perea y cols. (AAC 45:2676,2001) en 12 pacientes con VIH, con infección por 20 cepas de Candida, las que al comienzo eran sensibles al fluconazol, pero evolucionaron a la resistencia. Al estudiar las bombas se vio que en 11 cepas aisladas de 10 pacientes (55% de las cepas) había sobre expresión de CDR y en 83% de ellos había expresión simultánea de bombas CDR1 y CDR2. En 11 cepas aisladas de 8 pacientes había sobre expresión de bombas MDR. Sucede que las MDR y las CDR se expresen juntas en la misma cepa. En 42% de los pacientes, el mecanismo de resistencia era la upregulation de la molécula blanco, principalmente ERG11, y en 58% había mutación de la molécula blanco. Lo importante es que en la mayoría de las cepas aisladas había más de un mecanismo. La resistencia no es un fenómeno simple, con inducción de un mecanismo y punto. Es un problema vital complejo.
Para empeorarlo aún más, si se estudia Candida y se busca la expresión de CDR1 y CDR2, la expresión de ambas bombas es indetectable cuando se estudia en condiciones estándar (Medio YEPD a 30ºC), pero aumenta cuando se realiza el estudio NCCLS con exposición al fluconazol. Es igual que la expresión de beta lactamasas inducibles en las bacterias.
Otro aspecto interesante , como aparece en el trabajo de Marr et al, (AAC 42:2584,1998) es la resistencia cruzada, la que se observa al mantener cultivos de Candida en presencia de fluconazol (Figura 2). En diferentes tiempos, aparece la resistencia al fluconazol después de algunos días de terapia; posteriormente aparece resistencia al ketoconazol y al itraconazol. Si se hubiera usado posaconazol o voriconazol, se habría visto también la aparición de resistencia en el tiempo, por inducción de bombas, ya que todos son sustratos para CDR. Al suspender el fluconazol, la resistencia a los otros desaparece y el MIC vuelve a su valor basal. Esto complica un poco más el problema de manejar el tratamiento de los hongos.
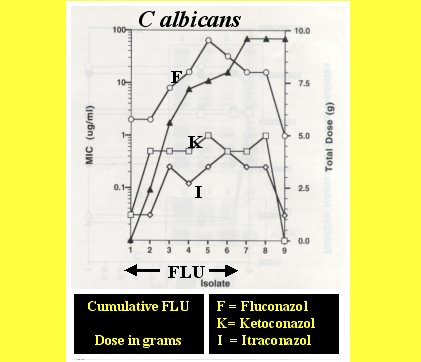 Tamaño completo
Tamaño completo Figura 2. Resistencia cruzada a antifúngicos.
El trabajo de Franz et al (AAC 42:3065,1998), demuestra que también se puede inducir la expresión de ERG , ya que ERG es la molécula blanco del fluconazol, la inosterol dimetilasa. A medida que aumenta la concentración de fluconazol, va aumentando la producción de ERG (Figura 3).
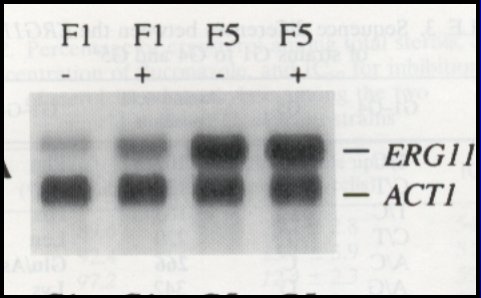 Tamaño completo
Tamaño completo Figura 3. Inducción de ERG por fluconazol.
¿Cómo funciona, entonces, el MIC y qué utilidad presta? En un estudio de 1000 pacientes en el área de Baltimore, en Connecticut, en busca de la resistencia al fluconazol en cepas aisladas de hemocultivos, se observó que la resistencia de C. albicans es 1%, lo que no es ninguna sorpresa; la de C. glabrata es 9%. Lo que sí fue una sorpresa para mí fue la resistencia en C. tropicalis: 18%. Probablemente la C. tropicalis va a ser la glabrata del futuro. También llama la atención que en las muestras que hemos visto en Chile hay mucha C. glabrata, pero también está apareciendo C. tropicalis. Por ahora, todavía son bastante sensibles al fluconazol, pero no hay ninguna garantía de que sigan igual en el futuro. En estos estudios, la mortalidad no se correlaciona bien con el MIC para fluconazol. Nuevamente aparece el fenómeno que estudió McCabe, que no siempre se fracasa con el tratamiento cuando el microorganismo es resistente, pero, probablemente, el número de fracasos sea mayor.
En el Hospital Fred Hutchinson, en la Unidad de Oncología, en pacientes con profilaxis con fluconazol, se observa que aun en esas condiciones la resistencia en C. albicans no es un problema mayor; en cambio, 99% de las C. glabrata aisladas son resistentes al fluconazol. En ese estudio, 30% de las C. tropicalis eran resistentes. Obviamente, aquí sobresale la C. glabrata, causante de los peores brotes.
Otro estudio, del MD Anderson, se orientó a la pesquisa de los brotes de fungemia en pacientes que recibían fluconazol. Los pacientes con C. albicans no presentaron muchos brotes de fungemia; éstos fueron más frecuentes en los casos de C. glabrata. La C. kruzei también fue más frecuente en el grupo de los que presentaron fungemia.
En todos estos estudios, en diversos hospitales, hay diferencias en la patología de base y en los esquemas de uso del fluconazol; sin embargo, la constante es que al usar fluconazol para proteger a los pacientes muy graves, principalmente los oncológicos, puede haber complicaciones por la aparición de resistencia.
¿Cómo se ha tratado de manejar esto? Hay mucho interés en los nuevos triazoles y en algunas partes se está promoviendo el voriconazol para estos casos; no en los Estados Unidos, donde aún no está aprobado. Hay un solo estudio disponible, aunque creo que deberíamos tener más datos sobre el voriconazol. En él, pacientes con candidemia y esofagitis, en quienes fracasó el tratamiento con fluconazol, se trataron con voriconazol: 6 entre 12 pacientes con candidiasis sistémica respondieron al voriconazol, 50% de respuesta, que no es ninguna maravilla. No parece, según esto, que el voriconazol sea la mejor alternativa en estos casos. En la esofagitis hubo respuesta en 14 de 21 casos. En la criptococosis, con MIC de 90, es decir, no resistente, la respuesta sólo se obtuvo en 7 de 18 casos, es decir que hay dificultad también para manejar el criptococo con estos esquemas. No hay que suponer que el voriconazol va a ser el medicamento perfecto para Candida, ni tampoco para criptococos.
Hay otras situaciones en las cuales la correlación clínica no es muy clara, pero hay algunos conceptos generales, que son los que voy a señalar.
El histoplasma en general responde relativamente mal al fluconazol. La mejor alternativa sería el itraconazol y los demás triazoles de amplio espectro. El Penicillium marnefeii, que es poco probable que llegue a invadir Chile, también es resistente al fluconazol y sensible al itraconazol, como también otros hongos menos frecuentes, algunos de los cuales son resistentes a la anfotericina B. Este es actualmente el principal campo de indicación de los nuevos triazoles. Aún no tenemos certeza de la manera como va a funcionar la caspofungina en estos casos.
Los deshidromyces son resistentes a todos los triazoles, excepto las Absidia, que son resistentes al itraconazol, pero ampliamente susceptibles al posaconazol. En nuestra experiencia, el posaconazol es eficaz en laboratorio y en experimentos con animales, y en el congreso de ICA de este año presentaremos una serie de 25 pacientes, con excelente respuesta. Creo que aquí hay un lugar para el posaconazol, que va a resultar mejor que el voraconazol en estos casos. Los Aspergillus terreus son resistentes a la anfotericina B y susceptibles a los triazoles y la caspofungina.
La actividad in vitro de los nuevos triazoles contra Aspergillus demuestra que, con la mayoría de estos hongos, los MIC son muy bajos, por lo que funcionan bien. Creo que el gran lugar para estos medicamentos va a estar en los Aspergillus y otras infecciones micelares.
Si se analiza los MIC de posaconazol y voraconazol contra hongos filamentosos, comparados con anfotericina B, se ve que con A. fumigatus andan bien, con MIC de 90. El A. terreus es sensible al itraconazol y posaconazol, pero resistente a la anfotericina B.
Tenemos que recordar que C. glabrata no es un villano sólo respecto al fluconazol. Lo es también con anfotericina B. La resistencia a anfotericina B es alta y se correlaciona con fracaso de tratamiento.
En un cultivo de Candida, se pueden apreciar las levaduras creciendo, con yemaciones que dan origen a células hijas (Figura 4A). Hay que recordar que tienen una pared que las protege contra daños. Con caspofungina, con MIC de 80%, se observa algún daño, pierden su forma y algunas llegan a parecerse a glóbulos rojos (Figura 4B). Hay menos yemas y no se ven células hijas. Con un MIC 16 veces mayor, solo se ven células muertas (Figura 4C); por lo tanto, este agente es realmente fungicida frente a Candida en el tubo de ensayo. La muerte de los hongos es muy rápida y no competitiva (Klepser et al. AAC. 42:1387,1998).
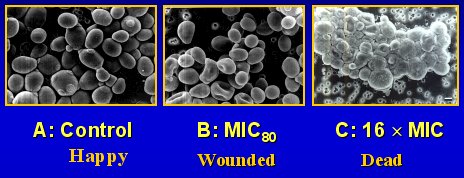 Tamaño completo
Tamaño completo Figura 4. Cultivo de Candida con caspofungina.
Con coloración supravital, se pudo observar que en el tubo control negativo todas las levaduras estaban viables; en el tubo control con etanol estaban todas muertas. A los 5 minutos de exposición a caspofungina, 86% de los organismos estaban muertos.
Comparando los rangos de concentración de caspofungina efectiva in vitro frente a diferentes cepas aisladas, se pudo ver que cuando se llegó a la concentración de 1 microg/ml, están casi todas muertas, menos la C. parapsilosis; en ésta, el nivel debe llegar a 4 microg/ml para lograr 100% de muertes (Pfaller MA, Diekema DJ, et al. AAC 47:1068-1071, 2003). Como la caspofungina tiene una intensa unión con proteínas, nos preguntamos si en la clínica habrá problemas para tratar C. parapsilosis con caspofungina.
Con las otras Candida resistentes al fluconazol, 95% de las S-DD y 99% de las R son susceptibles a caspofungina. Por tanto, se puede usar con bastante confianza la caspofungina para las Candida resistentes al fluconazol. El blanco de la caspofungina no es el ergosterol, sino el beta-1-3D-glucano, que está en la pared celular.
Con C. parapsilosis, hay un solo trabajo, publicado en el NEJM, no muy grande. Los pacientes se asignaron al azar a caspofungina o a anfotericina B. La C. parapsilosis es casi siempre sensible a la anfotericina B. Recuerden que a este hongo le encanta vivir en los catéteres, donde forma un biofilm que es imposible erradicar si no se cambia el catéter. Trece de veinte pacientes respondieron a la anfotericina, es decir, la respuesta fue de 65%. En el otro grupo respondieron catorce de veinte, 70%. La primera observación es que veinte no es un número de pacientes suficiente para postular que ambos medicamentos son o no equivalentes. Otra cosa sería si la diferencia fuera uno entre veinte contra trece entre veinte, en cuyo caso el resultado podría preocupar. Lo único que surge de este trabajo es que la caspofungina no es formidable contra la C. parapsilosis. No puedo decir, en este momento, que sea malo o antiético tratar con caspofungina a un paciente que tiene C. parapsilosis, sólo que necesitamos más resultados en series más grandes.
Nosotros participamos en un estudio que postula que si se mantiene la caspofungina, pueden aparecer problemas, como ocurrió con el fluconazol. Es un trabajo en ratones. Partimos con cepas de Candida muy resistentes al fluconazol, aisladas de pacientes con esofagitis. El MIC inicial de caspofungina era bueno. A las 4 semanas, seguía siendo bueno; pero a las 8 semanas apareció resistencia. Variando la dosis, se observó que los ratones tratados con dosis bajas de caspofungina dejaban de responder en el tiempo; en cambio, los tratados con dosis altas continuaban respondiendo.
En el manejo clínico de un paciente, a pesar de que respondía seguimos usando 50 mg /día de caspofungina. Este medicamento no tiene una dosis máxima tolerada. Yo quería usar 200 mg, pero mis amigos de Merck no me permitieron usar una dosis tan alta, aunque los estudios experimentales indican que probablemente habría respuesta al aumentar la dosis. Con este paciente, todo lo demás había fracasado. El medicamento es muy caro y el paciente estaba muy grave. No tengo la respuesta para esto.
Con los hongos filamentosos, el problema está en que se puede observar la muerte de las hifas, pero persisten pequeños acúmulos centrales que siguen vivos, y la calificación de fungistático o fungicida depende del punto que se considere como límite en los cambios morfológicos. El método in vitro aún no está bien estandarizado. Sucede, por ejemplo, con el Aspergillus, que por el método del MIC de Curtiss, aparecen todos como resistentes; por el método MEC, de cambios morfológicos, aparecen como sensibles y, en los pacientes, la droga funciona.
Los datos de caspofungina en hongos filamentosos son contradictorios. Con Histoplasma, Wheats sostiene que es mala, pero nosotros encontramos muy buena respuesta. También observamos buena respuesta en Coccidioidomyces susceptibles en ratones, de acuerdo con los datos de David Stevens.
Conclusiones
Es probable que el espectro de la caspofungina sea más amplio que Candida y Aspergillus, pero aún no lo sabemos claramente.
Sobre Candida:, existe correlación entre el MIC de fluconazol o de itraconazol y la respuesta clínica, pero no es firme y está mejor establecida para la esofagitis que para la candidemia; la resistencia al fluconazol es frecuente y puede cruzarse con voriconazol o posaconazol; y las equinocandinas son fungicidas contra Candida in vitro, por lo que hay mucho menos problemas de resistencia.
En cuanto a hongos dimórficos: También hay correlación entre MIC más altos y resistencia relativamente más elevada a fluconazol que a itraconazol para algunos hongos dimórficos (Histoplasma) y Penicillium marneffei. Voriconazol y posaconazol son más potentes.
Sobre hongos filamentosos: Las pruebas de sensibilidad no están bien estandarizadas. Hay algunas correlaciones clínicas, pero no concuerdan. Existe una alta letalidad, aún en el caso de hongos que son susceptibles. Hay otros factores importantes.

