Suplementos
← vista completaPublicado el 1 de agosto de 2008 | http://doi.org/10.5867/medwave.2008.07.558
Resultados de un régimen de dosificación inicial intensiva con Myfortic® en trasplantados de novo
Results of an initial intensive dosing regimen with Myfortic ® in de novo transplant
Resumen
Este texto completo es una transcripción editada y revisada de una conferencia dictada en el marco del simposio Esquemas Actuales y Futuros para Optimizar el Tratamiento con Ácido Micofenólico y sus Resultados, organizado por Novartis el 17 de abril de 2008, cuyo Chairman fue el Dr. Jorge Morales, profesor agregado de la Universidad de Chile y nefrólogo de Clínica Las Condes.
Introducción
Los trasplantólogos, los nefrólogos y todos los especialistas que se dedican al trasplante de órganos y que utilizan Simulect®, ciclosporina y Myfortic®, enfrentan diariamente interrogantes sobre las dosis correctas, la combinación más apta, la dosis mínima necesaria para lograr una inmunosupresión eficaz sin toxicidad, la interrelación entre estas drogas y las mejores opciones terapéuticas. En esta conferencia se expondrá algunas respuestas a estas dificultades.
El estudio que coordinó Brian Nankivell, del Departamento de Nefrología del Hospital Universitario de Westmead, de Sydney (Australia), es ampliamente conocido. En este estudio se evaluó a 120 pacientes, que habían recibido trasplante renal, mediante 961 biopsias de los riñones trasplantados, que se tomaron a intervalos regulares desde el momento del trasplante hasta 10 años después. Los autores describieron dos fases evolutivas de daño renal: una fase inicial de daño túbulo-instersticial precoz como consecuencia de isquemia y, un año después, una fase de nefropatía crónica del injerto, caracterizada por lesión microvascular y glomerular. La tasa de rechazo subclínico precoz fue frecuente; hubo alteraciones en 45,7% de las muestras de biopsia de los pacientes ya a los tres meses del trasplante; el riesgo fue mayor en presencia de un episodio anterior de rechazo grave y se redujo paulatinamente con el tratamiento con tacrolimus (TAC) y micofenolato. Muchos rechazos subclínicos están en la zona limítrofe, de modo que no queda claro si se debe tratarlos o no. El rechazo agudo ocurre principalmente en la primera semana y en el primer mes después del trasplante; luego la tasa de rechazo se va reduciendo claramente y la actividad inmune también (Fig. 1): las barras rojas, que indican rechazo agudo, desaparecen. En ese estudio se concluyó que la nefropatía crónica del injerto es el resultado de un daño acumulativo y creciente de los nefrones por causas inmunológicas y no inmunológicas, dependiente del tiempo.
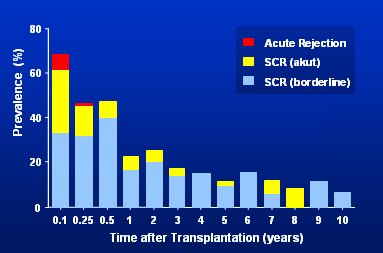 Tamaño completo
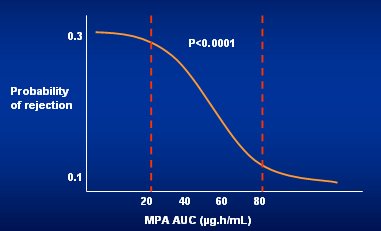
Tamaño completo Van Gelder y Hale, en Bélgica, estudiaron la relación entre la información farmacocinética dada por el área bajo la curva (AUC) de ácido micofenó|ico (MPA) y la prevención del rechazo después del trasplante renal. Los autores demostraron que a medida que aumenta la dosis, es decir, la exposición a MPA, el AUC es mayor y que el AUC de MPA predice la probabilidad de rechazo del injerto renal en pacientes tratados con mofetil micofenolato (MMF)(Fig. 2).
 Tamaño completo
Tamaño completo Otro aspecto importante que se debe considerar es que el nivel de exposición a MMF muestra gran variabilidad (Fig. 3). La línea horizontal corresponde al umbral más bajo de la ventana terapéutica y, como se ve, muchos pacientes no alcanzan esta ventana, especialmente en la primera semana después del trasplante, aunque después de 90 días la mayoría ya se encuentra sobre la ventana terapéutica; o sea, el mismo fenómeno que se observa en la figura anterior.
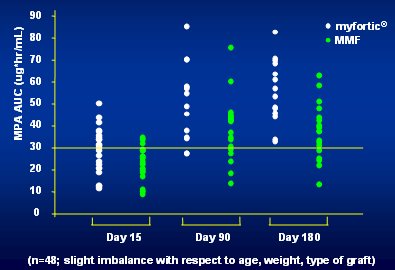 Tamaño completo
Tamaño completo El otro efecto importante, que también se conoce desde hace tiempo, se refiere a que el riesgo de rechazo depende de la exposición a MPA. En un estudio publicado hace 12 años se muestra muy bien que la baja exposición a MMF se asocia con un alto riesgo de rechazo, cercano a 30%, y que el rechazo y la exposición a MPA se correlacionan a la inversa. La Fig. 4 muestra los datos obtenidos en 41 pacientes japoneses con trasplante renal que recibieron MMF en dosis de 1 a 4 g/diarios.
 Tamaño completo
Tamaño completo Años más tarde, el grupo canadiense de Kiberd evaluó a un grupo de 94 pacientes con primer trasplante renal, mediante muestras de sangre tomadas en los días 3, 5 y 7, las que luego analizaron en retrospectiva. Se trató a todos los pacientes con ciclosporina y corticoides, y 72 recibieron basiliximab. Los resultados fueron muy buenos, con 15% de rechazo a los tres meses, pero sólo 47% de los pacientes lograron la meta terapéutica de AUC mayor de 30 µg.h/mL). El análisis ROC (AUC 30 µg.h/mL) demostró que el AUC era un buen predictor de rechazo; en cambio, la toxicidad no se asoció con la exposición a MPA.
En resumen: hay grandes variaciones entre los pacientes en cuanto a exposición a MPA; la exposición al fármaco se correlaciona a la inversa con el rechazo; esta exposición siempre va en aumento, porque la dosificación no es constante todo el tiempo; y, por último, la monitorización con C2, o cinética abreviada, es factible. La evaluación de la exposición no es fácil, ya que se necesita múltiples puntos cinéticos, en al menos tres momentos distintos. Frente a esto, cabe preguntarse si realmente la monitorización mejora los resultados.
Para responder a estas preguntas, Tom Van Gelder, de Rotterdam, Holanda, diseñó el gran estudio FDCC, aleatorio, multicéntrico (Europa y Brasil), en el que participaron 901 pacientes receptores de trasplante renal de novo, de los cuales 450 se asignaron a CC (Concentration Control) y 451, a FD (Fixed Dose). Los pacientes recibieron ciclosporina (CsA) (n = 483) o tacrolimus (TAC) (n = 418) y esteroides. El grupo FD recibió 1 g MMF (bid). En el grupo CC se hizo AUC a las 0, 0,5 y 2 horas y la meta fue mantener el nivel entre 30 y 60 µg.h/mL. El AUC se tomó en ambos grupos, pero el otro grupo era ciego, por lo que no se conocían los resultados. La monitorización se hizo en los días 3 y 10, y a las 4 semanas, a los 3 meses, y a los 6 meses. Los resultados fueron decepcionantes: no hubo ninguna diferencia en cuanto a fracaso del tratamiento, rechazo agudo comprobado por biopsia (BPAR), pérdida del injerto, muerte o discontinuación de MMF (Tabla I).
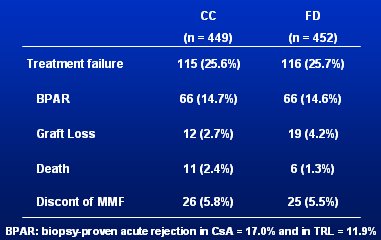 Tamaño completo
Tamaño completo En la Fig. 5 se ven los resultados de la monitorización. Si se observa a la población que recibió TAC, con dosis fija, en naranja y concentración controlada, en verde, a los tres meses prácticamente todos los pacientes estaban en el objetivo terapéutico. Luego la pregunta es si realmente hace falta monitorizar a los pacientes con TAC. En cambio, de los pacientes que recibieron CsA con dosis fija, en naranja, se puede ver que la mediana pasa por 30 y que alrededor de la mitad de ellos están subexpuestos a MPA con 2 g de MMF. La exposición a MPA con tacrolimus es más alta.
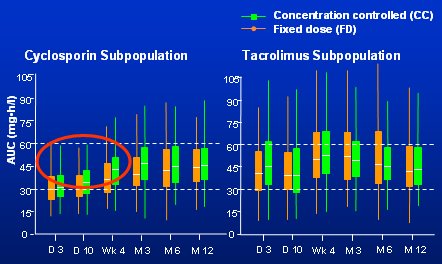 Tamaño completo
Tamaño completo Como ya se dijo, la concentración se incrementa con el tiempo y a las 4 semanas los pacientes ya han alcanzado el objetivo y permanecen dentro de ese rango. En este estudio, todo el empeño que se puso en monitorizar a los pacientes, tomar muestras de sangre y analizarlas no valió la pena, porque no hubo diferencia en el logro de los objetivos primarios entre los dos grupos en estudio (FD y CC). La explicación de lo anterior es compleja: por una parte, los investigadores serían renuentes a ajustar la dosis de MMF basándose solamente en los niveles de MPA; por otra, no hay una relación proporcional entre la dosis y el AUC. Por supuesto, los autores del estudio se preguntaron si los médicos no adoptaron dosis suficientemente altas y si deberían haberlas aumentado. Para responder la pregunta, revisaron el grado de cumplimiento del protocolo en cuanto a incremento de la dosis con AUC menor de 25 y comprobaron que en sólo 46% de los casos se hizo el cambio correcto de dosis; es decir, los médicos no cumplieron lo que el protocolo decía (Tabla II).
 Tamaño completo
Tamaño completo Las principales conclusiones del estudio FDCC fueron las siguientes:
- La relación entre exposición a MPA y eficacia se ve solamente en las primeras semanas; de hecho, la exposición en el día 3 predice la aparición de rechazo en el primer año y lo mismo vale para el día 10, pero no para el día 28; la mayoría de los rechazos se observan en el primer mes y sólo 15% de ellos ocurren después de ese lapso. Si no se presentan rechazos, no hay necesidad de mejorar el resultado.
- El porcentaje de pacientes en el rango elegido de exposición a MPA fue similar en ambas ramas del estudio.
- Varios médicos fueron reacios a hacer los grandes cambios de dosis que indicaba el protocolo, aunque muchos sí los hicieron.
- Con una dosis de inicio de 2 g/día de MMF en pacientes tratados con TAC, la exposición a MPA es excelente y la incidencia de BPAR es baja.
- En pacientes tratados con CsA, una dosis de inicio más alta (los autores plantean 3g/día) de MMF podría optimizar la exposición precoz a MPA después del trasplante.
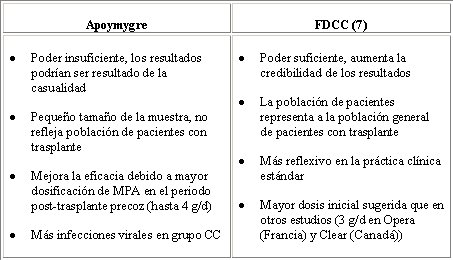
Hay un segundo estudio similar a éste: el Apoymygre, pequeño estudio francés con sólo 137 pacientes, todos tratados con el protocolo CsA, MMF, esteroides y Simulect®. La mitad de los pacientes fueron asignados aleatoriamente al grupo CC, con toma de muestras para AUC y el objetivo de AUC de 40 ug.h/mL, o al grupo FD, con MMF 1 g bid. Se hizo monitorización con el mismo método del estudio anterior, comenzando los días 7 y 14, y meses 1, 3, 6 y 12. El estudio fue pequeño, pero su diseño fue similar al del FDCC y se obtuvo resultados positivos, por lo que se publicó en American Journal of Transplantation, a diferencia del FDCC, que fue mucho más grande, pero que no se publicó porque los editores piensan que si un estudio tiene resultados negativos es porque no se diseñó bien. El estudio francés no fue totalmente correcto, porque cinco pacientes del grupo CC y dos del grupo FD no alcanzaron el día 7, presentaron rechazo en el día 5 ó 6, y se les excluyó del análisis. Los datos se resumen en la Tabla III, en el que se observa que la monitorización aumenta significativamente la eficacia del tratamiento, aunque el costo sea una tasa mayor de infecciones virales.
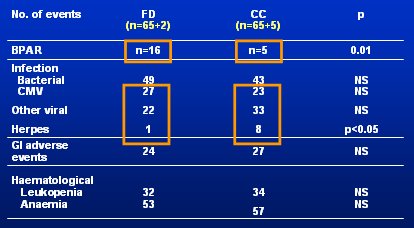 Tamaño completo
Tamaño completo Durante la primera semana más de la mitad de los pacientes estuvieron bajo la ventana terapéutica (Fig. 6), pero después, con las estrategias de monitorización, se incrementó la dosis a 2,7 y 2,9 g (cabe recordar que en el otro estudio el incremento fue 2,6 y 2,7 g). Pasado un mes, hubo un gran aumento en la exposición, el que fue muy marcado el día 14. Por tanto, a pesar de la monitorización, la ocurrencia de baja exposición en el primer mes también estuvo presente en este estudio.
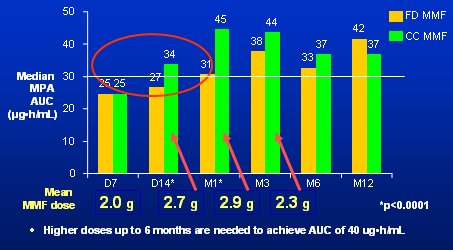 Tamaño completo
Tamaño completo En la Tabla IV se compara el estudio Apomygre con el estudio FDCC.
 Tamaño completo
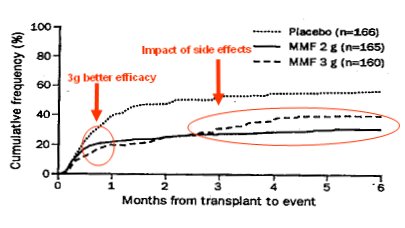
Tamaño completo Ahora Van Gelder plantea usar 3 g de MMF, pero hace 12 años se publicó un estudio en el que se comparó micofenolato (CellCept®), en dosis de 2 y 3 g, y placebo. En ese estudio (Fig. 7) se observó que con 3 g la eficacia era un poco mayor durante los primeros meses y que había menos casos de ineficacia, principalmente rechazos; pero, a partir de los tres o cuatro meses, los pacientes del grupo de 3 g presentaron dificultades de tolerancia y muchos discontinuaron el tratamiento.
 Tamaño completo
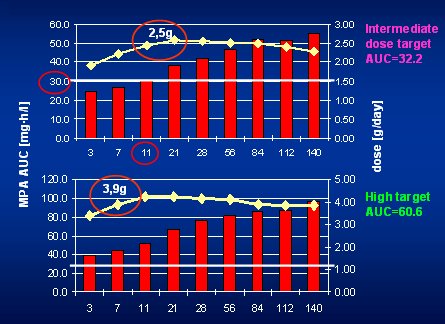
Tamaño completo Luego Van Gelder demostró que cuando se usan dosis altas permanentemente, luego de 3 ó 4 meses se presentan problemas de tolerancia, porque la exposición empieza a aumentar y se produce una sobreexposición en muchos pacientes que están sobre la ventana terapéutica. Los problemas de tolerancia ocurrieron cuando la exposición sobrepasó el nivel de 80; antes de eso hubo muy pocos problemas de tolerancia. Es decir, lo que se describió en el estudio Apomygre con 4 g de MMF no fue nada nuevo. Del mismo estudio, en la Fig. 8 se muestra que se necesita dosis de MMF mayor de 2 g precozmente post transplante para obtener AUC mayor de 30 mg.h/l.
 Tamaño completo
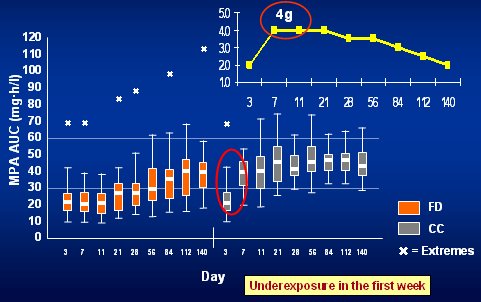
Tamaño completo En la Fig. 9 se observa una simulación computacional que hizo Van Hest, donde planteó que con una exposición bajo 30 habría que incrementar la dosis hasta 4 g para alcanzar el rango deseado (AUC mayor de 30 µg.h/m); pero lo anterior se puede obtener sólo con monitorización y, si ésta se hace, sólo se incrementa la dosis cuando se está monitorizando. En el estudio francés, como la monitorización se hizo a los 7 días, se excluyeron todos los rechazos ocurridos antes. Sólo cuando se hace monitorización entre los días 3 y 7 se alcanza la exposición y, de acuerdo con todos los datos, dicho período es el más crítico. Por lo tanto, cuando se hace monitorización siempre se tendrá baja exposición durante la primera semana.
 Tamaño completo
Tamaño completo Hay otro estudio publicado y poco conocido que se efectuó en Francia, en el cual también se utilizaron altas dosis de MMF, a partir de 3 g. Se estudió a una pequeña cohorte de 54 receptores de primer o segundo trasplante de ECD (Expanded Criteria Donor) que tuvieron inducción con 10 dosis de timoglobulina (n = 14) o con Simulect® administrado en los días 0 a 4 (n = 40), más corticoides (500 mg (pretrasplante), 125, 20 mg/d); luego recibieron MMF 2 g antes del trasplante, 3 g diarios durante 45 días y 2 g diarios posteriormente, de modo que durante las primeras semanas recibieron 3 g de MMF diarios. Además recibieron Neoral® ajustado según niveles C2 (600 a 800 ng/ml) desde el día 7. Los resultados no fueron tan malos: sólo hubo 11% de rechazos, es decir, 6 pacientes entre 54, pero hubo muchas reducciones de dosis por efectos secundarios (55%), principalmente gastrointestinales (67% ); en cambio, hubo escasa interrupción de tratamiento (9%) y baja tasa de infecciones por CMV (1,5%).
Régimen de dosificación inicial intensiva (estudios Optimyze y myID)
En resumen, la evidencia plantea que es útil usar dosis de MPA más altas que las que se recomienda habitualmente en pacientes tratados con CsA. Este procedimiento ya se había intentado, pero la tolerancia a altas dosis de MMF por tiempos prolongados se vio limitada por problemas gastrointestinales. Los datos dan a entender que un régimen inicial intensivo de MPA podría mejorar los niveles y los resultados en forma equivalente a la monitorización terapéutica de fármacos.
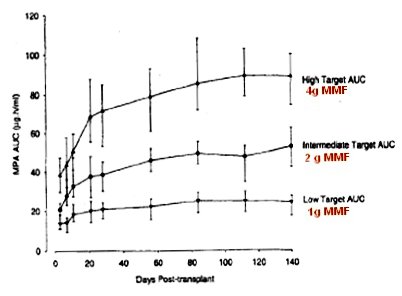
Ya se describió el estudio de Hale (Fig. 2), donde se comenzó con 4 g, se redujo a 3 g y luego a 2 g, a las 6 semanas, y se logró una exposición constante durante todo el tiempo, similar a lo descrito con TAC. Con esta base surgió la idea de probar la eficacia de un régimen de dosificación inicial intensiva con EC-MPS (Enteric-Coated MycoPhenolate Sodium), con el objetivo de alcanzar AUC de MPA mayores de 30 mg.h/L precozmente postrasplante. Con tal fin se utilizó dos enfoques: el National Feasibility Study (Optimyze) n = 120, y el Multinacional Study (myID) n = 306, con el mismo diseño: pacientes adultos receptores de trasplante renal de novo, asignados aleatoriamente, 1:1, a dos ramas de tratamiento: EC-MPS intensivo (2880 mg/día) + CsA, esteroides, además menos inducción usando antagonista del receptor de IL-2 (IL-2RA) basiliximab; o bien EC-MPS estándar (1440 mg/día) + CsA, esteroides, además menos inducción con IL-2RA (basiliximab). El uso de basiliximab dependió de cada centro. En el régimen intensivo se administró 2880 mg/día por dos semanas, luego se redujo la dosis a 2160 mg por cuatro semanas y luego, a los 42 días, se llegó a la dosis habitual de 1440 (Fig. 10).
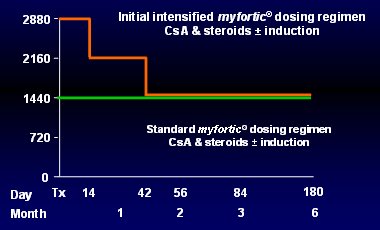 Tamaño completo
Tamaño completo En la Fig. 11 se observa que con el nuevo esquema se obtuvo la meta, ya que con la dosis estándar se llegó a un nivel de AUC de MPA de 32,7 en promedio, lo que significa que muchos pacientes estuvieron subexpuestos; en cambio, con la dosis intensiva de Myfortic® se alcanzó la meta en una proporción significativamente mayor, después de sólo tres días.
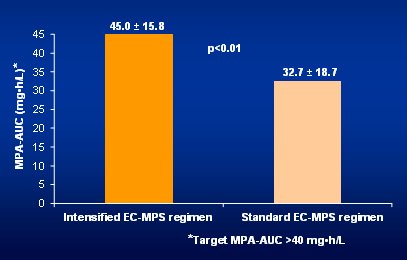 Tamaño completo
Tamaño completo Uno de los problemas del monitoreo terapéutico de medicamentos es que siempre se piensa que hay una relación directa entre dosis y exposición, pero la verdad es que, cuando se duplica la dosis, la exposición se incrementa sólo en 50%; la relación es lineal, pero esta línea es más ondulante de lo que se esperaría. En la Fig. 12 se muestran los resultados de las tres primeras semanas: los pacientes del grupo con dosis alta, en naranja, están dentro del rango objetivo, entre 30 y 60; en cambio, el otro grupo tuvo niveles menores, los que se incrementaron lentamente. Por tanto, se logró el primer objetivo del estudio.
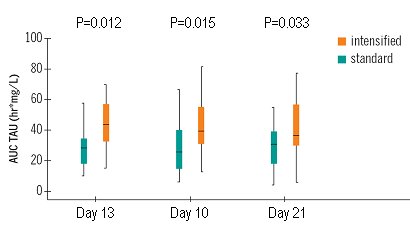 Tamaño completo
Tamaño completo En la Fig. 13 se observa que la exposición fue significativamente mayor en el grupo con dosis altas (> 40mg.h/L) en el día tres.
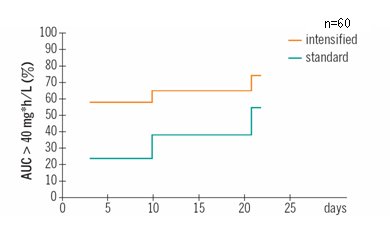 Tamaño completo
Tamaño completo En cuanto al perfil de seguridad, datos preliminares obtenidos de los setenta primeros pacientes plantean que no hubo diferencias entre ambos grupos en cuanto a episodios gastrointestinales, excepto en diarrea (12 entre 30, en el grupo de dosis alta versus 6 entre 30), aunque no significó reducción de las dosis; tampoco hubo diferencias en las infecciones más importantes, aunque se usó profilaxis para CMV en todos los0pacientes. Tampoco hubo diferencias en la incidencia de eventos hematológicos como leucopenia, que es frecuente en el período inicial, pero que se previene con dosis altas de esteroides (Fig. 14).
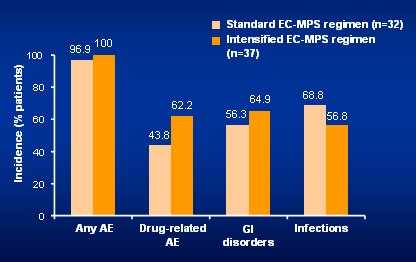 Tamaño completo
Tamaño completo Este estudio todavía está en curso, de modo que los datos disponibles hasta ahora se deben interpretar con cuidado; pero la información preliminar da a entender que la dosificación inicial alta es muy eficaz (Fig. 15).
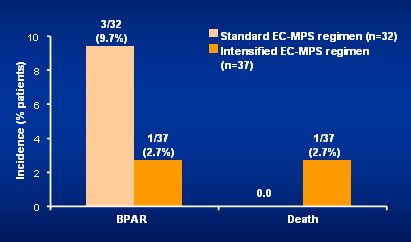 Tamaño completo
Tamaño completo El estado actual de los estudios Optimyze y myID indica que el registro de pacientes de ambos aún no está completo; el estudio Optimyze tiene 134 pacientes, el estudio myID, poco más de 150; después se deberán analizar los datos obtenidos.
Conclusiones
- La hipótesis actual de los estudios Optimyze/MyID es que la dosis alta inicial de EC-MPS permite obtener el objetivo de AUC de MPA > 30 mg.h/L dentro de los tres primeros días.
- En las próximas etapas se deberá determinar si esta estrategia mejora en forma significativa el resultado del injerto a largo plazo.
- Asimismo, se deberá encontrar el régimen más seguro para la combinación con EC-MPS, con miras a obtener la máxima eficacia con la menor toxicidad.

