Análisis
← vista completaPublicado el 15 de noviembre de 2021 | http://doi.org/10.5867/medwave.2021.10.8484
Antígeno leucocitario humano C y receptores tipo inmunoglobulina en medicina reproductiva
Human leukocyte antigen-C and killer immunoglobulin-like receptors in reproductive medicine
Resumen
Una adecuada comunicación entre las células asesinas naturales en la interfase materno-fetal con las moléculas de los antígenos de histocompatibilidad del trofoblasto embrionario es clave en el éxito de la reproducción. Sin embargo, combinaciones de determinados antígenos leucocitarios humanos tipo C embrionarios con los receptores tipo inmunoglobulina presentes en las células asesinas naturales deciduales (el código inmunológico del embarazo), pueden asociarse con morbilidad obstétrica y pérdidas gestacionales. En este artículo se presenta una revisión actualizada de los mecanismos subyacentes a la interacción entre el antígeno de histocompatibilidad tipo C embrionario y los receptores tipo inmunoglobulina maternos, y su relevancia tanto en la fisiología como en la fisiopatología de la reproducción humana.
|
Ideas clave
|
Introducción
Las complicaciones relacionadas con el embarazo representan un verdadero reto para los profesionales de la salud, son relativamente frecuentes y tienen consecuencias devastadoras para los pacientes y sus familias [1],[2]. La preeclampsia afecta entre 3 y 5% de todos los embarazos, siendo una de las principales causas de morbilidad y mortalidad materna y neonatal. Entre 15 y 20% de todos los embarazos finalizan en aborto y hasta 5% de las parejas experimentan abortos de repetición [3]. Aunque las alteraciones genéticas embrionarias se consideran responsables de la mayoría de los abortos esporádicos, aproximadamente 40% de los embriones euploides, empleados en reproducción asistida, o bien no llega a implantar o se pierde en etapas precoces del embarazo [4].
Debido a que estas enfermedades tienen una fisiopatología común, con el fin de mejorar los resultados perinatales y de las terapias de reproducción asistida, es indispensable avanzar en el conocimiento de los mecanismos implicados en la implantación y en el desarrollo placentario. Actualmente se sabe que, aunque este es un proceso multifactorial, la interacción entre moléculas de los antígenos de histocompatibilidad del embrión y las células del sistema inmunitario materno presentes en la interfase materno-fetal es clave en el éxito de la gestación.
El riesgo de desarrollar preeclampsia o eclampsia [5], abortos de repetición [6], alteraciones del crecimiento fetal [7],[8] y fallos de implantación en las terapias de reproducción asistida [9],[10] se han relacionado con el tipo de moléculas antígeno del leucocito humano C que expresa el embrión y el genotipo de receptores de tipo inmunoglobulina (killer immunoglobulin-like receptors o KIR) en las células asesinas naturales de la madre, hasta el punto de considerar al antígeno del leucocito humano C embrionario como un factor de riesgo para el desarrollo de algunas de estas patologías.
En la presente revisión se esbozan los principios fundamentales de la interacción entre el antígeno del leucocito humano C embrionario y los receptores KIR de las células asesinas naturales maternas, su efecto sobre la actividad de las células asesinas naturales uterinas en la interfase materno-fetal y la importancia que esta tiene en el desarrollo de la placenta, en la evolución del embarazo, así como las posibles patologías obstétricas que pueden explicarse por las variaciones en esta interacción antígeno del leucocito humano C/KIR.
Las células asesinas naturales uterinas y el trofoblasto extravellositario como promotores del desarrollo placentario
La inmunidad innata desempeña un papel fundamental en la reproducción humana. En la decidua, el 90% de las células del sistema inmunitario materno pertenecen a la inmunidad innata (células asesinas naturales uterinas y macrófagos). En tanto, entre 3 y 10% corresponde a células de la inmunidad adaptativa, representada principalmente por linfocitos T reguladores [11].
En condiciones basales, la población de células asesinas naturales uterinas en el endometrio varía en función del ciclo menstrual: experimentan apoptosis masiva en la fase premenstrual, se descaman junto al resto del endometrio durante la menstruación [12] e incrementan progresivamente tras la ovulación, especialmente durante la ventana de implantación, preparando el endometrio para la gestación. Si esta ocurre, proliferan aún más desde el embarazo temprano y durante todo el primer trimestre, concentrándose inicialmente en la decidua basal cerca del sitio donde ocurre la implantación [12]. A partir del segundo trimestre comienzan a disminuir, hasta retornar a valores basales al final del embarazo [13].
En el primer trimestre del embarazo a su vez, las células asesinas naturales uterinas llegan a ser la población mayoritaria y representan aproximadamente el 70% de las células de la inmunidad innata [11]. El 20% restante está integrado principalmente por macrófagos (MΦ) y aunque estos son la población más numerosa después de las células asesinas naturales uterinas, se conoce menos su función en el embarazo. No obstante, se sabe que las células asesinas naturales uterinas y macrófagos, predominantemente de fenotipo antinflamatorio o M2, participan de forma coordinada en la remodelación de las arterias espirales, producen predominantemente interleucina (IL)-10 y M-CSF [14]. También, son capaces de inhibir la actividad de los linfocitos T e inducir su diferenciación hacia células T reguladoras, al menos in vitro [15],[16].
Aunque aún es materia de debate, se ha demostrado que las células asesinas naturales uterinas tienen un origen diverso y que su particular distribución en torno a los tejidos embrionarios, obedece a diferentes mecanismos [17]. Las células progenitoras de células asesinas naturales uterinas, provenientes de la médula ósea, son capaces de proliferar y diferenciarse hacia células asesinas naturales residentes por influencia de la interleucina-15. Esta citoquina es producida por las células del estroma endometrial en respuesta al aumento de la progesterona que ocurre después de la ovulación y durante el embarazo temprano [18]. Por otra parte, también existe evidencia de que las células endometriales y el trofoblasto producen quimioquinas como CXCL9/Mig, CXCL10/IP-10, CXCL12/SDF-1, CCL4/MIP-1β y CCL3/MIP-1α. Estas moléculas ejercen potentes efectos quimiotácticos sobre las células asesinas naturales de sangre periférica [19],[20],[21] favoreciendo su reclutamiento y migración. El estudio de la expresión de diversas moléculas en la superficie de las células asesinas naturales ha permitido caracterizar múltiples subpoblaciones (inmunofenotipos) con funciones diferentes, en sangre periférica, órganos linfoides secundarios y en tejidos, como el endometrio y la decidua, que es donde finalmente estas células ejercen su función.
Clásicamente, las células asesinas naturales se han dividido en dos grandes grupos según la densidad de expresión de la molécula de adhesión celular CD56 y la presencia o ausencia de CD16 (receptor tipo III de la región Fc de baja afinidad de la inmunoglobulina G). En sangre periférica, entre el 90 y 95% de las células asesinas naturales son de tipo CD56dim/CD16+, tienen una importante capacidad citotóxica y liberan interferón-γ rápidamente tras su activación. El 10% restante está constituido por células asesinas naturales CD56bright/CD16− que tienen una capacidad citotóxica muy reducida y principalmente producen citoquinas y quimioquinas, como interferón-γ, factor de necrosis tumoral-α, interleucina-12, interleucina-15 y factor estimulante de colonias de granulocitos y monocitos [22]. Estas últimas son el fenotipo predominante en órganos linfoides secundarios y en diversos tejidos, incluyendo el endometrio y la decidua.
Sin embargo, aunque las células asesinas naturales presentes en la decidua exhiben un inmunofenotipo mayoritario CD56bright/CD16−, son muy diferentes de sus homólogas en sangre periférica; tanto de las CD56dim/CD16+ como de las CD56bright/CD16− [23], pues adicionalmente, expresan una serie de moléculas como CD9, CD69, CD49a que se consideran marcadores de residencia y las identifican [22] y un repertorio único de receptores similares a inmunoglobulina [24]. La expresión de estos receptores es de vital importancia, ya que en la interfase materno-fetal, se favorece la interacción de las células asesinas naturales deciduales con un conjunto de ligandos expresados de forma selectiva por el trofoblasto extravellositario: las moléculas de antígeno del leucocito humano C, antígeno del leucocito humano-E y antígeno del leucocito humano-G [25]. Esta capacidad de interacción recíproca ha llevado a que se consideren a las células asesinas naturales deciduales como células asesinas naturales especializadas en la regulación del desarrollo placentario.
Desde el punto de vista funcional las células asesinas naturales deciduales poseen también características particulares. Producen una variedad de factores de crecimiento vascular endotelial-A, factor de crecimiento vascular endotelial-C y factor de crecimiento placentario (factor de crecimiento placentario), que regulan la angiogénesis durante la formación de la placenta [25] y citoquinas como la interleucina-8, factor de necrosis tumoral-α e interferón-γ. La interleucina-8 promueve la migración del citotrofoblasto [25], mientras que el factor de necrosis tumoral-α y el interferón-γ más bien la inhiben [26]. Adicionalmente, son fuente importante de GM-CSF, CSF-1 y factor inhibidor leucémico que juega un papel determinante durante la implantación [27].
En condiciones normales, a las células asesinas naturales uterinas no se les atribuye actividad citotóxica directa frente al embrión o al trofoblasto, a pesar de que expresan varios receptores activadores como NKp30, NKp44, NKp46, CD244 [13], contienen en su citoplasma gránulos de perforina, granzima y granulisina y mantienen intacta su maquinaria citolítica [28]. En algunas situaciones concretas, en cambio, como en la trombocitopenia autoinmune fetal-neonatal, la activación de las células asesinas naturales de sangre periférica y la citotoxicidad mediada por anticuerpos pudiera tener un rol fisiopatológico fundamental. En modelos animales, se ha demostrado que el trofoblasto de hembras sensibilizadas por embarazos previos, expresa antígenos plaquetarios que forman inmunocomplejos capaces de activar a las células asesinas naturales de sangre periférica, causando aborto, villitis crónica y disfunción placentaria que puede ser revertida mediante la administración de gammaglobulina intravenosa [29],[30],[31],[32],[33],[34].
Durante la gestación, las arterias espirales del útero se transforman en conductos flácidos y en consecuencia, la sangre materna fluye de forma lenta y constante en el espacio intervelloso, permitiendo el adecuado intercambio de nutrientes y oxígeno que se necesita para el desarrollo fetal [35]. Las células asesinas naturales deciduales se sitúan en contacto directo con el trofoblasto extravellositario y alrededor de las arteriolas espirales en etapas tempranas del embarazo [36], regulan la invasión del trofoblasto [37] y son fundamentales para el proceso de remodelación de estos vasos.
La remodelación defectuosa de las arterias espirales se ha relacionado con diversas patologías obstétricas: abortos tardíos [38], preeclampsia, crecimiento intrauterino retardado [39],[40] e incluso parto pretérmino [41]. Se piensa que todas estas patologías tienen un origen común en la disfunción trofoblástica y en el desarrollo de la placenta [42]. Más aún, la magnitud del defecto influye directamente en el resultado obstétrico; las alteraciones más severas se manifiestan antes y son causa de aborto, mientras que alteraciones más leves se manifiestan más tardíamente y son causa de crecimiento intrauterino retardado y preeclampsia [43].
Para una normal remodelación de las arterias espirales, el citotrofoblasto vellositario, que se encuentra en contacto con la decidua en la base de las vellosidades de anclaje, se separa, formando el trofoblasto extravellositario. El trofoblasto extravellositario invade la decidua, alcanza la pared arterial previamente desestructurada por acción de las células asesinas naturales deciduales [44] y sustituye la lámina elástica y la pared muscular, junto a un material fibrinoide amorfo que escapa al control vasomotor [45]. Adicionalmente, penetra la luz de estos vasos, dando origen al trofoblasto endovascular (TV) que se extiende también, en sentido proximal [36].
En fases iniciales del desarrollo placentario, el TV ocluye por completo la luz de región terminal de las arterias espirales impidiendo la perfusión del espacio vellositario. Alrededor de la décima semana de embarazo, cuando esta oclusión desaparece, es cuando realmente entran en contacto directo la sangre materna y las vellosidades coriales, dando origen a la placenta hemocorial [45].
El desarrollo inicial de la placenta y del embrión, antes de las 10-12 semanas de embarazo y por tanto, de la perfusión de las vellosidades coriales, ocurre en un ambiente con baja presión parcial de oxígeno, mediante factores de crecimiento y proteínas producidos por las glándulas endometriales [46]. En situaciones patológicas en las que se produce un aumento de la presión parcial de oxígeno en esta etapa, ocasionado por la perfusión precoz o descoordinada de este espacio vellositario, aumenta el estrés oxidativo a nivel de la placenta y del embrión causando atrofia vellositaria y aborto [47].
Tanto la migración endovascular como la intersticial del trofoblasto extravellositario son necesarias e interdependientes [48] y en el embarazo normal, se extienden hasta el tercio interno del miometrio [36]. La modificación del segmento de arteria que se encuentra inmediatamente proximal a la unión endomiometrial resulta particularmente importante, al punto de que se considera, a esta zona del miometrio, un tejido especializado. Fuera del embarazo, la vasoconstricción de las arterias espirales a este nivel limita la cantidad de sangre que se pierde durante la menstruación. Durante el embarazo la modificación de este segmento garantiza la adecuada perfusión del espacio vellositario. Cuando la invasión trofoblástica no alcanza esta unión endomiometrial, es insuficiente o superficial y aumenta el riesgo de desarrollar aborto, preeclampsia y crecimiento intrauterino retardado [49].
Desde el punto de vista clínico, la alteración en la remodelación de las arterias espirales del útero se evalúa de manera indirecta mediante la velocimetría Doppler de la arteria uterina. La persistencia del notch protodiastólico e índice de pulsatilidad elevado por encima del percentil 95 desde la semana 11 hasta la 14, son marcadores de riesgo para el desarrollo de preeclampsia [50].
La perfusión anómala del espacio intervelloso, que se produce como consecuencia de esta remodelación defectuosa, ocasiona daño vellositario y finalmente disfunción placentaria. La placenta disfuncional e hipóxica libera moléculas solubles de tirosin quinasa1 (sFlt-1) y endoglobina a la circulación materna, que se asocian a las manifestaciones clínicas de la preeclampsia (hipertensión, proteinuria, trastornos de la coagulación, disfunción hepática, respuesta inflamatoria sistémica y disfunción endotelial marcada) disminuyendo la biodisponibilidad de factores proangiogénicos como el PlGF [51]. El cociente sFlt-1/factor de crecimiento placentario aumentado se asocia directamente con el desarrollo de preeclampsia y es útil para identificar pacientes de muy alto riesgo, que requieren interrupción inminente de la gestación y con pronóstico materno y neonatal adverso [52],[53],[54].
Las moléculas de antígeno leucocitario humano en el trofoblasto modulan la actividad de las células asesinas naturales uterinas
La expresión selectiva de moléculas de antígeno del leucocito humano en la superficie del trofoblasto es esencial para el adecuado desarrollo del embarazo [55]. En condiciones normales, el sincitiotrofoblasto carece de moléculas de antígeno del leucocito humano de clase I y de clase II [56],[57],[58], mientras que el trofoblasto extravellositario expresa únicamente moléculas de clase I (antígeno del leucocito humano C, antígeno del leucocito humano-E, antígeno del leucocito humano-F y antígeno del leucocito humano-G) [59],[60].
La ausencia de las moléculas de clase I y de clase II (antígeno del leucocito humano-DP, antígeno del leucocito humano-DQ y antígeno del leucocito humano-DR) en la superficie del sincitiotrofoblasto y de moléculas de clase II en el citotrofoblasto, evita la respuesta aloinmune mediada por células T frente al antígeno del leucocito humano de origen paterno [61].
La expresión de moléculas de clase II por el trofoblasto se considera anómala y se ha relacionado con diversas patologías obstétricas. Por ejemplo, se ha observado que el sinciotiotrofoblasto y el citotrofoblasto de embarazos finalizados en aborto de causa inexplicada entre las 12 y 24 semanas, expresan moléculas de antígeno del leucocito humano-DR, y no están expresadas en placentas de controles sanos con embarazos finalizados mediante interrupción voluntaria [62]. En el sincitiotrofoblasto de placentas de embarazos a término, la expresión de moléculas de antígeno del leucocito humano-DR, DP y DQ se ha visto circunscrita a zonas de villitis, mucho más frecuentes en mujeres con historia de abortos de repetición secundarios [63]. Adicionalmente, se ha demostrado la presencia de antígeno del leucocito humano-DR en el sincitiotrofoblasto de mujeres con preeclampsia [61] y en el citotrofoblasto endovascular de mujeres con preeclampsia asociada a remodelación deficiente de las arterias espirales [64].
A diferencia de lo que ocurre con las moléculas de clase II, la expresión de moléculas de clase I por el trofoblasto se considera fundamental para la gestación. Desde el punto de vista genético, estas pueden ser oligomórficas (antígeno del leucocito humano-E y antígeno del leucocito humano-G) o polimórficas (antígeno del leucocito humano C) y su expresión es particularmente importante en el trofoblasto extravellositario. La unión de estas moléculas a receptores específicos en las células asesinas naturales uterinas genera señales inhibitorias o activadoras que controlan la citotoxicidad y promueven la secreción de citoquinas necesarias para la placentación durante la primera mitad del embarazo [65].
Las moléculas de antígeno del leucocito humano-E expresadas por el trofoblasto extravellositario son reconocidas por receptores NKG2A/NKG2C en la superficie de las células asesinas naturales uterinas [66]. En estas células, la señal inhibitoria que resulta de esta interacción predomina sobre la mayoría de señales activadoras [67]. La función del antígeno del leucocito humano-E parece restringida al proceso de implantación y desarrollo temprano del embrión, dado que el trofoblasto no expresa moléculas de antígeno del leucocito humano-E después de la séptima semana de embarazo [60]. El antígeno del leucocito humano-G embrionario, a su vez, es capaz de interactuar al menos con dos tipos de receptores en las células asesinas naturales uterinas: LILRB1 [68] y KIR2DL4 [69],[70]. Mediante la unión a estos receptores el antígeno del leucocito humano-G estimula la secreción de citoquinas como interleucina-6, interleucina-8 y factor de necrosis tumoral [70] y favorece la tolerancia inmunológica en la interfase materno-fetal [71],[72]. El trofoblasto extravellositario es uno de los pocos tejidos que expresa antígeno del leucocito humano-G en condiciones fisiológicas [73]. Asimismo, su interacción con KIR2DL4, presente casi en la totalidad de los individuos, se considera esencial para el proceso reproductivo. No obstante, en 2004 Gómez-Lozano y colaboradores, reportaron el caso de una mujer multípara, sin historia de complicaciones obstétricas y ausencia de 2DL4. Ello sugiere que al igual que en otras áreas del sistema inmunitario, existen mecanismos redundantes en las células asesinas naturales deciduales que pueden compensar alteraciones o pérdidas puntuales de algún receptor [74].
El antígeno del leucocito humano C presente en el trofoblasto extravellositario es reconocido por diversos KIRs en las células asesinas naturales uterinas a nivel de la interfase materno-fetal [66]. Estas son las únicas moléculas de clase I polimórficas. La expresión de diferentes alotipos se ha asociado a diversos resultados reproductivos dependiendo del repertorio KIR que presenten las células asesinas naturales uterinas [75]. Los KIR son capaces de reconocer la totalidad de alotipos de antígeno del leucocito humano C y una pequeña variedad de alotipos antígeno del leucocito humano-A (A3/11) y antígeno del leucocito humano-B (Bw4) [76]. Debido a que el trofoblasto extravellositario no expresa el antígeno del leucocito humano-A ni el antígeno del leucocito humano-B, como se ha mencionado anteriormente, esta interacción no será objeto de esta revisión.
La unión entre el antígeno del leucocito humano C y el receptor KIR está determinada por el dimorfismo de un aminoácido en la posición 80 del dominio α-1 de la molécula de antígeno del leucocito humano C. Las moléculas que contienen asparagina en posición 80 forman el epítopo C1 y las que contienen lisina, el epítopo C2 [77],[78]. En función de esto, los más de 1000 alelos de antígeno del leucocito humano C descritos, pueden ser clasificados en dos grupos: C1 y C2, respectivamente.
Aunque esta interacción no es específica, KIR 2DL2 y 2DL3 reconocen con mayor afinidad epítopos C1 mientras que KIR 2DL1, 2DS1 y 2DS4 reconocen con mayor afinidad el epítopo C2. La unión de alelos C1 y los KIR 2DL2 y 2DL3 produce una señal inhibitoria débil en las células asesinas naturales deciduales, mientras que la unión de C2 a KIR 2DL1 se traduce en una señal inhibitoria fuerte [55]. Por el contrario, la unión de C2 a KIR 2DS1 [37], 2DS4 [79] y posiblemente algunos alelos de 2DS5 presentes en la región centromérica de población de origen africano, no en la europea [80], activan las células asesinas naturales deciduales.
La inhibición de las células asesinas naturales uterinas que resulta de la interacción entre antígeno del leucocito humano C2 y KIR2DL1, disminuye la degranulación y la liberación de citoquinas (interleucina-8, factor de crecimiento vascular endotelial, PGF y CXCL10) que influyen en el desarrollo del trofoblasto extravellositario [25]. Por el contrario, la activación mediada por KIR2DS1 y KIR2DS4 induce el aumento de la degranulación de las células asesinas naturales uterinas [81] y de la secreción de GM-CSF y factor de necrosis tumoralα [79],[82]. A pesar de que KIR 2DL1 y 2DS1 reconocen el mismo ligando (antígeno del leucocito humano C2), la afinidad del primero es 3,5 veces superior [83]. Un fenómeno similar ocurre con KIR 2DL2, 2DL3 y 2DS2 y el antígeno del leucocito humano C1: aunque estos receptores reconocen el mismo ligando, la afinidad de unión de 2DL2 es mayor que la de 2DL3, mientras que la unión de antígeno del leucocito humano C1 a 2DS2 en muchos estudios ha sido aún menor o no ha podido ser demostrada [83]. Esto implica que en el caso de que las células asesinas naturales deciduales expresen los dos receptores predominará el efecto inhibidor sobre el activador.
Finalmente, independientemente del epítopo que se presente a las células asesinas naturales, las moléculas de antígeno del leucocito humano C se expresan en la superficie celular de diferente manera. Su expresión es modulada por diferencias estructurales que condicionan desde su transcripción hasta su capacidad de unión a péptidos intracelulares [84].
La magnitud de la expresión de moléculas de antígeno del leucocito humano en la superficie celular modifica la intensidad de la respuesta inmunológica [84]. Su expresión ha sido relacionada con la evolución de la infección por VIH y el riesgo de progresión a SIDA [85], con el riesgo de desarrollar enfermedad de Crohn [86] y con la evolución del trasplante de progenitores hematopoyéticos. En este último, las incompatibilidades de antígeno del leucocito humano C mejor toleradas correspondieron a alelos que se expresan menos en la superficie celular, incluyendo aquellos que por el grado de discordancia con el antígeno del leucocito humano C del receptor pueden resultar más inmunogénicos [87]. Según estudios realizados por Apps y colaboradores [85], los alelos con más expresión fueron en el grupo C1: C*14, C*01 y C*12 y en grupo C2: C*18, C*06 y C*15; mientras que los menos expresados estuvieron en el C1: C*16,C*08, C*03,C*07 y en el C2:C*04,C*02,C*05 y C*17.
El nivel expresión de moléculas de antígeno del leucocito humano C hasta ahora ha sido similar en los diferentes grupos étnicos estudiados [85].
Receptores KIR: estructura, organización genética y funcional
Los KIR son proteínas de membrana que se expresan en determinadas subpoblaciones de células asesinas naturales presentes en el endometrio/decidua, en sangre periférica y en algunos linfocitos T [88].
El loci KIR comprende un conjunto de 14 genes y dos pseudogenes, ubicados en una secuencia continua de aproximadamente 150 kilobases, dentro del complejo de receptores de los leucocitos, en el cromosoma 19 (19q13.4) [88]. Entre estos, se distinguen ocho KIR inhibidores (2DL1, 2DL2, 2DL3, 2DL4, 2DL5, 3DL1, 3DL2 y 3DL3), seis KIR activadores (2DS1, 2DS2, 2DS3, 2DS4, 2DS5 y 3DS1) y dos pseudogenes (2DP1 y 3DP1).
Cada receptor está formado por dos o tres dominios extracelulares similares a inmunoglobulina (KIR2D y KIR3D, respectivamente) acoplados a un dominio transmembrana y a una región citoplásmica (tallo citoplasmático), que puede ser corto (S) o largo (L). En general, los tallos citoplasmáticos largos se asocian a inmunorreceptores inhibidores basados en tirosina y los tallos cortos a moléculas de señalización intracelular activadoras del tipo DAP12 o ITAM [89]. La excepción a esta regla es el KIR2DL4. A diferencia del resto de KIR que se expresan en la superficie celular, el KIR2DL4 se localiza predominantemente en endosomas e interactúa con el antígeno del leucocito humano-G que ingresa a la célula mediante trogocitosis [72]. Por otra parte, aunque tiene un tallo citoplasmático largo, es capaz de transmitir señales activadoras y lejos de favorecer la citotoxicidad de las células uterinas asesinas naturales, estimula la secreción de citoquinas que favorecen el desarrollo placentario [90].
Cada KIR es, a su vez, codificado por un gen individual integrado por ocho o nueve exones que corresponden a cada uno de los dominios que forman el receptor. En los KIR 3D (3DL1 y 3DL2, por ejemplo), los exones 1 y 2 codifican el péptido señal; los exones 3, 4 y 5 los dominios extracelulares similares a inmunoglobulina (D0, D1 y D2); los exones 6 y 7 las porciones extracelular y transmembrana del tallo, respectivamente; y los exones 8 y 9 la porción intracitoplasmática [89]. En los KIR 2D ocurre de forma similar. Sin embargo, en estos KIR se distinguen dos grupos. Los KIR del grupo 1 (KIR2DL1, 2DL2, 2DL3, 2DS1, 2DS2, 2DS3, 2DS4 y 2DS5) carecen de dominio D0 y el dominio similar a inmunoglobulina que se encuentra en el extremo distal (N-terminal) es de tipo D1. Este último es codificado por el exón 4 del gen KIR correspondiente. En cambio, los del grupo 2 (KIR2DL4 y 2DL5) carecen de dominio D1 y el dominio distal corresponde a un dominio D0 que es codificado por el exón 3 del gen [88].
Variaciones genéticas a diferentes niveles pueden modificar las características de las proteínas KIR: su nivel de expresión en la superficie celular, su afinidad por las moléculas de antígeno del leucocito humano de clase I y los mecanismos de señalización intracelular.
Los genes KIR están dispuestos en haplotipos con contenido génico variable, delimitados por genes que se conservan en la gran mayoría de individuos y se consideran marco de referencia (framework). Estos genes se ubican en los extremos centromérico y telomérico de cada haploptipo y en la región central. El extremo centromérico de los haplotipos KIR es demarcado por 3DL3, el extremo telomérico por 3DL2 y la zona central por 3DP1 y 2DL4 [91]. La distancia que separa a 3DP1 y 2DL4 (de 5 a 14 kilobases) es algo mayor que la que separa al resto de los genes KIR (3 kilobases) [92]. Este es el punto de recombinación genética más frecuente y que se utiliza para delimitar dos zonas dentro del haplotipo, también llamados motivos: un motivo centromérico entre 3DL3 y 3DP1, y un motivo telomérico entre 2DL4 y 3DL2. La mayoría de los haplotipos presentes en la población pueden ser explicados por la recombinación de estos motivos centroméricos y teloméricos [91].
El Comité de Nomenclatura del Genoma Humano de la Organización Mundial de la Salud distingue dos haplotipos, el A y el B. El haplotipo B se caracteriza por la presencia de KIR2DL5, 2DS1, 2DS2, 2DS3, 2DS5 y 3DS1; mientras que el haplotipo A por la ausencia de estos genes [93]. En función de su contenido génico, el haplotipo A estaría conformado por un contenido definido de genes (KIR3DL3-2DL3-2DP1-2DL1-3DP1-2DL4-3DL1-2DS4-3DL2) [94]; y el haplotipo B, por un contenido variable de genes, caracterizado por la ausencia de KIR2DL3, 3DL1 y 2DS4 [95].
Excluyendo los KIR framework, el haplotipo A resulta de la combinación de un motivo centromérico A (cen-A o cA), constituido por KIR2DL3-2DL1-2DP1, y un motivo telomérico A (tel-A o tA), constituido por KIR3DL1-2DS4. De forma similar, en el haplotipo B se identifican un motivo centromérico B (cen-B o cB) y un motivo telomérico B (tel-B o tB). Los motivos B, a diferencia de los motivos A, tienen contenido génico variable. En los motivos cen-B están presentes KIR2DS2 y 2DL2, acompañados o no de KIR2DL1 y 2DP1 y en los motivos tel-B, KIR3DS1 y 2DS1. Aunque los genes KIR 2DL5, 2DS3 y 2DS5 son exclusivos del haplotipo B, pueden estar presentes tanto motivos cen-B como en motivos tel-B [93]. Debido a que un individuo hereda un haplotipo de cada progenitor, los individuos con genotipo A (AA) son portadores de dos haplotipos A completos, dos motivos cen-A y dos motivos tel-A. Los individuos con genotipo B (BB) son portadores de dos haplotipos B completos, dos motivos cen-B y dos tel-B. Sin embargo, los individuos con genotipo AB pueden ser portadores de cualquier combinación de motivos centroméricos y teloméricos A y B (Figura 1), de tal manera que dos personas de genotipo AB pueden tener contenido génico muy diferente.
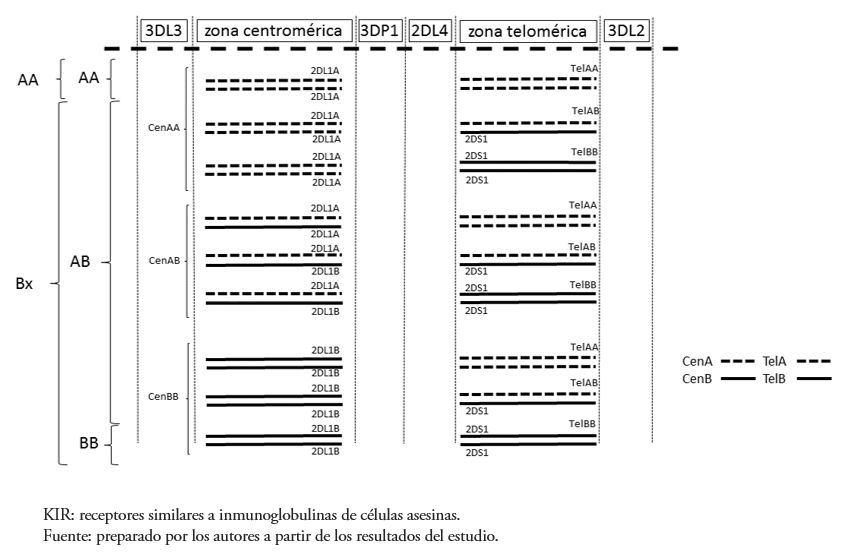 Tamaño completo
Tamaño completo La región KIR es una de las regiones más polimórficas del complejo de receptores leucocitarios. A la variabilidad generada por las diferentes combinaciones entre motivos centroméricos y teloméricos, se suma el polimorfismo alélico. La mayor diversidad alélica se ha registrado en África Oriental y parece ir disminuyendo conforme las poblaciones se van alejando de esta región geográfica. La mayor diversidad registrada corresponde a la población de Ga-Adangbe (Ghana, África Oriental), mientras que la mínima diversidad se ha registrado en las poblaciones nativas de América, como la Yucpa (Venezuela) [77]. El polimorfismo alélico es especialmente importante en los genes del haplotipo A. No obstante, los motivos cen-B o tel-B con el mismo contenido génico muy probablemente tendrán el mismo contenido alélico [91].
En la base de datos del Instituto Europeo de Bioinformática, hasta el momento, se han registrado 977 alelos para los 16 genes KIR. El gen más polimórfico es 3DL3 (164 alelos descritos) y los menos polimórficos son el KIR 2DS3 y 2DS1 (16 alelos registrados para cada uno). Para el KIR 2DL1 se han descrito 64 alelos, mientras que para KIR2DL2, KIR 2DL3 y KIR 2DS4 se han descrito 33, 59, 37 alelos, respectivamente (www.ebi.ac.uk/ipd/kir/). El polimorfismo de 2DL1 y 2DL2/3 (ambos receptores inhibidores para antígeno del leucocito humano C2 y antígeno del leucocito humano C1) contrasta con lo conservado que se mantiene KIR2DS1 (receptor activador para antígeno del leucocito humano C2) [96].
En el contexto de la reproducción humana, el estudio de las diferentes combinaciones entre el antígeno del leucocito humano y KIR, se realiza excluyendo los genes framework y tomando en cuenta solamente aquellos KIR que interactúan con el antígeno del leucocito humano C, única molécula de antígeno del leucocito humano polimórfica que expresa el trofoblasto extravellositario.
Siguiendo esta premisa, en el haplotipo A están presentes dos receptores inhibidores centroméricos (KIR2DL3 y 2DL1) y un 1 receptor activador telomérico (KIR2DS4). A su vez, en el haplotipo B se identifican dos receptores inhibidores centroméricos (KIR2DL2 y 2DL1) y un receptor activador telomérico (KIR 2DS1).
Aunque desde el punto de vista teórico la configuración de ambos haplotipos es similar, desde el punto de vista funcional se comportan de forma diferente. La expresión de los receptores KIR en la superficie de las células asesinas naturales deciduales, la afinidad por sus ligandos y las características de sus mecanismos de señalización intracelular son las principales variables que explican esta diferencia. Estas a su vez están predeterminadas por el contenido genético y condicionados por el polimorfismo alélico (98). En este orden de ideas, el haplotipo A se caracteriza por un predominio de KIR inhibidores y el haplotipo B por un predominio de KIR activadores.
En las células asesinas naturales deciduales de individuos con haplotipo A, la unión del antígeno del leucocito humano C2 a KIR2DL1 produce una señal inhibitoria fuerte, que no puede ser contrarrestada por la estimulación de 2DS4 (único receptor activador presente en este haplotipo). La estimulación de KIR2DS4, favorece la trogocitosis, mecanismo principal de la adquisición de antígeno del leucocito humano-G en la células asesinas naturales [97]. Sin embargo, en la población europea los alelos KIR2DS4 que se identifican con mayor frecuencia en la población (KIR2DS4*003/004/006), se caracterizan por una deleción de 22 pares de bases que introduce una mutación en su marco de lectura y sintetizan una proteína soluble con un solo dominio similar a inmunoglobulina intacto que no se une al antígeno del leucocito humano C (KIR2DS4del) [79]. La unión de antígeno del leucocito humano C1 con el KIR2DL3 también produce una señal inhibitoria sobre la célula asesina natural decidual. Sin embargo, esta es mucho más débil y hasta el momento no se ha considerado relevante.
Por el contrario, en las células asesinas naturales deciduales de individuos con haplotipo B, la unión del antígeno del leucocito humano C2 a KIR2DS1 produce una señal activadora fuerte que contrarresta el efecto de la inhibición mediada por KIR2DL1. De forma similar a lo que ocurre en el haplotipo A con KIR2DL3, la unión del antígeno del leucocito humano C1 a KIR2DL2 produce una señal inhibitoria débil sobre las células asesinas naturales deciduales [55].
Otro aspecto importante que contribuye a la diferencia funcional entre estos dos haplotipos es el polimorfismo alélico. Aunque no todos los alelos KIR descritos se han secuenciado completamente, en general, los alelos KIR2DL1 que se segregan en los motivos Cen A producen una respuesta inhibitoria mayor y tienen mayor avidez por el antígeno del leucocito humano C2 que los segregados en los motivos Cen B. Por el contrario, los alelos KIR2DL2/3 segregados en los motivos Cen A producen una respuesta inhibitoria menor y tienen menor avidez por el antígeno del leucocito humano C1 que los segregados en los motivos Cen B [96].
En la población europea, los alelos KIR2DL1 que se asocian con más frecuencia al haplotipo A son KIR2DL1*003, *002 y *001 y pueden ser agrupados como KIR2DL1A. En el haplotipo B en cambio, KIR2DL1*004 es mucho más frecuente y puede ser designado 2DL1B [98]. Este último tiene menor avidez por el antígeno del leucocito humano C2 y produce una señal inhibitoria de menor intensidad que KIR2DL1*003 [99].
En individuos portadores de ambos alelos (KIR2DL1A/B), se ha demostrado que la población de células asesinas naturales (de sangre periférica y deciduales) que expresa KIR2DL1A es significativamente mayor que la que expresa KIR2DL1B y que solo una pequeña población coexpresa ambos alelos. En las células asesinas naturales que expresan simultáneamente KIR2DL1A y KIR2DL1B, la respuesta inhibitoria es mayor que en las que expresan únicamente KIR2DL1B, pero menor que en las que expresan solo KIR2DL1A. Esto sugiere que la magnitud del efecto inhibidor está relacionada con el número de copias de KIR2DL1A que estén presentes en el genotipo del individuo [55]. De esta manera, los portadores de dos motivos CenA tendrán dos copias de 2DL1A (la dosis génica máxima).
La capacidad efectora de la célula asesina natural depende del repertorio de receptores que expresa en su superficie. A diferencia de otras células del sistema inmunitario como los linfocitos T y B que son capaces de generar receptores clonotípicos mediante reordenamiento genético y de reconocer de forma específica gran variedad de antígenos, las células asesinas naturales ejercen su efecto citotóxico de forma directa, o mediada por anticuerpos en respuesta a una gran variedad de estímulos. Su respuesta rápida y relativamente inespecífica es fundamental en la respuesta antiviral y antitumoral temprana. Esta depende de un mecanismo estrechamente regulado que les sirve para adaptarse al organismo en el que se desarrollan y evita que su respuesta efectora sea autodestructiva [100]. Este control se logra mediante la expresión de una serie de receptores inhibidores (como los KIR) capaces de reconocer moléculas de antígeno del leucocito humano de clase I, que, al ser expresado por la totalidad de las células del organismo con excepción de los hematíes, permiten a la célula asesina natural reconocer “lo propio” de lo “no propio” (self/nonself).
Las células asesinas naturales adquieren este repertorio de receptores de forma estocástica, dependiendo del contenido genético, generándose múltiples subpoblaciones de células asesinas naturales con combinaciones diferentes de receptores (fenotipo) en el mismo individuo [101]. No obstante, este pool de receptores se va modelando a medida que estos interactúan con sus ligandos específicos (moléculas de antígeno del leucocito humano) en el resto del organismo. El proceso mediante el cual la célula asesina natural modela su repertorio definitivo de receptores y, por lo tanto, desarrolla su competencia funcional, se conoce como educación permitiéndole a la célula asesina natural adquirir su “licencia para matar” [102].
En general, las células asesinas naturales que desarrollan mayor capacidad citotóxica se caracterizan por expresar receptores inhibidores potentes que limitan su capacidad autodestructiva, mientras que las células asesinas naturales que expresan inhibidores débiles, o con poca afinidad por su ligando, tienen una capacidad citotóxica menor. En consecuencia, los receptores inhibidores potentes son determinantes para la educación de las células asesinas naturales [101].
Durante su diferenciación, las células asesinas naturales de sangre periférica expresan primero el receptor NKG2A (que como se ha mencionado ejerce un potente efecto inhibidor sobre la célula asesina natural) y posteriormente los KIR [101]. Si los receptores KIR que expresa la célula encuentran su ligando específico (moléculas de antígeno del leucocito humano C constitutivas) y se produce una señal intracelular suficientemente intensa como para frenar la respuesta citotóxica, este receptor se conserva y la célula deja de expresar NKG2A. Adicionalmente, se ha observado que las células asesinas naturales expresan KIR2DL2, 2DL3 y 2DS2 antes que KIR2DL1 y 2DS1. Por lo tanto, la expresión de estos últimos en ausencia de NKG2A se ha considerado signo de diferenciación [103],[104].
En sangre periférica, el repertorio KIR de las células asesinas naturales está condicionado por el antígeno del leucocito humano C del individuo. Las células asesinas naturales endometriales, en cambio exhiben un repertorio único de receptores que es independiente del antígeno del leucocito humano C. Adicionalmente, mientras que un porcentaje similar de células asesinas naturales endometriales y células asesinas naturales de sangre periférica expresan KIR2L1/S1, el porcentaje de células asesinas naturales endometriales que expresa NKG2A, LILRB1, KIR2DL2/L3/S2, KIR2DL3 es significativamente mayor. La expresión de NKG2A en estas células pudiera favorecer el efecto inmunomodulador del antígeno del leucocito humano-E, que como se ha mencionado, parece cumplir un papel fundamental en etapas precoces del embarazo [66]. El repertorio de receptores presente en las células asesinas naturales endometriales sugiere que estas son células inmaduras que alcanzan su diferenciación final una vez que se ocurre el embarazo en presencia del antígeno del leucocito humano C embrionario.
En el estudio de la decidua entre las 8 y 12 semanas, obtenida de mujeres que acudieron a interrupción voluntaria, se ha observado que más de 90% de las células asesinas naturales deciduales expresa NKG2A. Sin embargo, la expresión de KIR en las células asesinas naturales deciduales es condicionada por el antígeno del leucocito humano C materno, no por el antígeno del leucocito humano C fetal. El porcentaje de células asesinas naturales deciduales KIR2DL1+ en mujeres con al menos un epítopo C2 es significativamente menor que en mujeres C1/C1. Por el contrario, el porcentaje de células asesinas naturales deciduales KIR2DL3+ es mayor en mujeres C1/X que en mujeres C2/C2 [105].
El conocimiento del proceso de educación de las células asesinas naturales deciduales resulta fundamental para explicar cómo las diferentes combinaciones entre el antígeno del leucocito humano C fetal y el genotipo KIR materno pueden contribuir al desarrollo del embarazo.
En la evidencia obtenida hasta el momento, las mujeres KIR AA tienen mayor riesgo de desarrollar preeclampsia, crecimiento intrauterino retardado y aborto cuando se embarazan con fetos que expresan el epítope C2. Este efecto parece ser especialmente importante cuando el epítopo C2 fetal es de origen paterno (cuando la madre es C1C1 o cuando el embrión es C2C2). Determinadas combinaciones entre los KIR y el antígeno del leucocito humano C que inhiben las células asesinas naturales deciduales pueden impedir una adecuada invasión trofoblástica y contribuir al desarrollo posterior de preeclampsia, el crecimiento intrauterino retardado o a la pérdida gestacional [17],[37]. Estos mismos autores sugieren, en casos de mujer con KIR AA que se somete a reproducción asistida con donante de esperma o de ovocitos, seleccionar donante antígeno del leucocito humano C1/C1 para evitar en lo posible la preeclampsia [55].
El resultado adverso en esta situación se atribuye a que la unión entre el antígeno del leucocito humano C2 del embrión, expresado en el trofoblasto extravellositario, y KIR2DL1 inhibe a las células asesinas naturales deciduales disminuyendo la secreción de citoquinas proangiogénicas en el lecho placentario. La actividad deficiente de la célula asesina natural decidual se traduce en una invasión trofoblástica superficial y en una remodelación deficiente de las arterias espirales. Las arterias espirales defectuosas conducen la sangre materna de forma inadecuada al espacio intervelloso, alterando el desarrollo vellositario. Como consecuencia, la placenta libera una serie de mediadores químicos que son responsables de las alteraciones sistémicas características de la preeclampsia. Finalmente, la afectación masiva de las vellosidades coriales ocasiona insuficiencia placentaria comprometiendo el desarrollo fetal.
En mujeres con genotipo AB y BB, la presencia de KIR2DS1 disminuye el riesgo de complicaciones. En esta situación, la unión del antígeno del leucocito humano C2 fetal y KIR2DS1 activa las células asesinas naturales deciduales contrarrestando el efecto inhibidor de KIR2DL1 [106]. En la población europea el alelo KIR2DL1 que se asocia con más frecuencia al CenB es KIR2DL1*004. Según lo descrito con anterioridad, este alelo codifica un receptor que se expresa menos en la superficie celular, tiene menor afinidad por el antígeno del leucocito humano C2 y ejerce un efecto inhibitorio más débil que los alelos asociados a los motivos CenA (llamados en conjunto KIR2DL1A) [98].
Recientemente, mediante el estudio fenotípico y genético de alta resolución, se ha demostrado que es específicamente KIR2DL1A el que se asocia al aumento de riesgo de preeclampsia. Además, en este estudio, el riesgo de preeclampsia estuvo en relación directa con la dosis génica de KIR2DL1A, siendo mayor en mujeres con dos alelos KIR2DL1A (CenAA) [98].
En mujeres con genotipo BB, caracterizado por la ausencia de KIR2DL1A y por la presencia de dos alelos KIR2DS1, el antígeno del leucocito humano C2 activa la célula asesina natural decidual favoreciendo la implantación profunda y el desarrollo placentario. Se ha observado que en mujeres con genotipo KIRBB son más frecuentes los fetos de mayor peso y esto pudiera conducir a un aumento de complicaciones obstétricas durante el trabajo de parto [106].
Sin la intervención médica oportuna, tanto la invasión superficial (que puede asociarse a aborto, preeclampsia y crecimiento intrauterino retardado), como la invasión profunda del trofoblasto extravellositario (que puede asociarse al incremento del peso fetal y posiblemente a acretismo placentario), se han relacionado al aumento de la morbilidad y mortalidad materna y perinatal. Asimismo, podría haber modulado la distribución poblacional del antígeno del leucocito humano C y KIR a través de la evolución [107].
Conclusiones
La implantación y el desarrollo placentario dependen de la comunicación entre el embrión y el sistema inmunitario materno en la interfase materno-fetal. La expresión selectiva de moléculas de antígeno del leucocito humano permite al trofoblasto extravellositario interactuar con diversos receptores que modulan la actividad de las células asesinas naturales deciduales, reduciendo su citotoxicidad y favoreciendo la secreción de citoquinas proangiogénicas promotoras del desarrollo placentario. Del resultado de esta interacción depende la correcta remodelación de las arterias espirales del útero y la irrigación del espacio vellositario.
Las moléculas de antígeno del leucocito humano C y los genes KIR son altamente polimórficos. Sin embargo, han conservado la capacidad de reconocer estas moléculas a lo largo de la evolución. La interacción entre el antígeno del leucocito humano C embrionario y KIR se considera fundamental para la reproducción. El hecho de que KIR2DS1 sea uno de los más conservados evolutivamente refuerza esta idea. La unión al antígeno del leucocito humano C2 embrionario activa la célula asesina natural decidual, lo que favorece el desarrollo placentario, disminuye el riesgo de complicaciones obstétricas asociadas a la presencia de KIR2DL1A, principal receptor inhibidor.
El estudio de la interacción antígeno del leucocito humano C/KIR mediante técnicas de biología molecular y su incorporación a algoritmos diagnósticos y terapéuticos, pudiera permitir avances importantes en la prevención de las complicaciones del embarazo. De la misma manera, podría mejorar el resultado de las técnicas de reproducción asistida. Todos ellos son objetivos principales de la inmunoperinatología y de la inmunología de la reproducción.
Notas
Autoría
ERF: preparación del borrador original, revisión y edición, visualización. MFA: conceptualización, revisión y edición y visualización. NSIM: preparación del borrador original, revisión y edición, visualización y administración del proyecto. AO: metodología, preparación del borrador original, revisión y edición y visualización. IC: revisión y edición y visualización. MAH: conceptualización, metodología, validación, revisión y edición y visualización. SSR: conceptualización, metodología, validación, preparación del borrador original, revisión y edición, visualización, supervisión y administración del proyecto.
Conflictos de intereses
Los autores refieren no tener conflictos de interés y haber completado el formulario del IMCJE. Además, declaran no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado y no tener otras relaciones o actividades que podrían influir sobre el artículo.
Financiamiento
El proyecto ha recibido financiación del Instituto de Salud Carlos III, Ministerio de Economía y Competitividad en 2019 en la Acción Estratégica de Salud 2019-2020, con referencia PI19/01450. y está cofinanciado por el Fondo Europeo de Desarrollo Regional (FEDER)
Consideraciones éticas
Debido a la naturaleza del estudio, no requirió de la evaluación de un comité de ética.
Idioma de envío
Español.

