Revisión clínica
← vista completaPublicado el 16 de noviembre de 2017 | http://doi.org/10.5867/medwave.2017.09.7090
Preservación de la fertilidad en la paciente oncológica
Fertility preservation in the oncology patient
Resumen
En los últimos años, los avances médicos han mejorado sustancialmente la sobrevida de los pacientes con cáncer, generando una mayor preocupación por la calidad de vida de los sobrevivientes. En particular, se ha prestado una creciente atención a los problemas reproductivos posteriores a los tratamientos oncológicos. Las pautas internacionales sobre la preservación de la fertilidad en pacientes con cáncer, recomiendan que los equipos de salud debatan lo más pronto posible con todos los pacientes en edad reproductiva el impacto de la terapia sobre el sistema reproductor. También insta a que se disponga y facilite el acceso oportuno a técnicas de preservación de la fertilidad. El desarrollo de estas técnicas en mujeres pre y post puberales son un esfuerzo reciente, y muchos pacientes y proveedores de la salud no están familiarizados con el rápido avance en su investigación. En la presente revisión se exponen las indicaciones, resultados y riesgos de las diferentes opciones disponibles en la actualidad.
Introducción
Cada año, en el mundo se le diagnostica cáncer a más de 14 millones de personas y 8,2 millones fallecen por esta enfermedad [1]. Según la Organización Mundial de la Salud, más de la mitad de los diagnósticos y 65% de las muertes ocurre en los países en desarrollo [2]. En Chile cada año son diagnosticadas cerca de 40 mil personas con cáncer, constituyendo la segunda causa de muerte [3].
Uno de cada dos hombres y una de cada tres mujeres desarrollará cáncer en su vida. En Estados Unidos se diagnostica un cáncer cada 23 segundos y hay más de 10 millones de supervivientes de esta enfermedad, lo que supone aproximadamente 4% del total de la población de ese país [4]. La mayoría de las neoplasias aparecen en etapas avanzadas de la vida, sin embargo, 10% de estos casos ocurre en menores de 45 años de edad [5]. Los avances en la detección, diagnóstico y tratamiento del cáncer han elevado el índice de supervivencia, observándose en la última década una disminución de las tasas globales de mortalidad atribuibles al cáncer en mujeres de 1,6% por año [6]. Estudios estiman que cerca de 68% de los pacientes diagnosticados con cáncer están vivos a cinco años de tratamiento, y que para 2016 una de cada 21 personas fue una sobreviviente de algún cáncer [7],[8].
A medida que las tasas de curación y supervivencia aumentan, las consecuencias de los tratamientos cobran mayor relevancia. Una de las principales secuelas que surge como consecuencia de terapia oncológica es la pérdida parcial o definitiva de su capacidad reproductiva, impactando negativamente la salud y la calidad de vida de las mujeres. En vista de ello, existe un creciente interés entre los oncólogos y los especialistas en reproducción, por considerar la preservación de la fertilidad como un componente esencial en el enfoque integral del tratamiento del cáncer [9]. A pesar de lo anterior, la literatura científica sobre la materia es aún limitada, particularmente, para los hispanoparlantes. El presente artículo, describe y discute las opciones actuales para la preservación de la fertilidad en niñas y mujeres con cáncer, destacando los conocimientos vigentes sobre la seguridad, el acceso y el éxito de cada opción.
Métodos
Se realizó una búsqueda de artículos en la base de datos de MEDLINE/PubMed. Se eligieron artículos indexados desde el año 1990 al año 2016. Se incluyeron artículos de revisión, ensayos clínicos y experimentales en modelos animales. Para la búsqueda se emplearon los términos MeSH: Fertility Preservation, Neoplasms e Infertility, Female. Se identificaron 176 artículos, correspondiendo 95 a revisiones de la literatura, cinco de ellos a metanálisis y dos ensayos clínicos controlados, a partir de los cuales se realizó una revisión narrativa o no sistemática. La información extraída de cada artículo fue incluida de acuerdo al consenso de los autores del manuscrito.
Resultados
a. Foliculogénesis y el impacto de la radio y quimioterapia sobre la fertilidad
La ovogénesis comienza cuando las células germinales primordiales migran hacia la gónada embrionaria. El número máximo de ovocitos se alcanza a las 20 semanas de gestación, donde entre seis y siete millones de células germinales pueden ser identificadas en la gónada femenina. Desde entonces, se observa una pérdida progresiva de la reserva folicular por atresia, que termina en la menopausia [10].
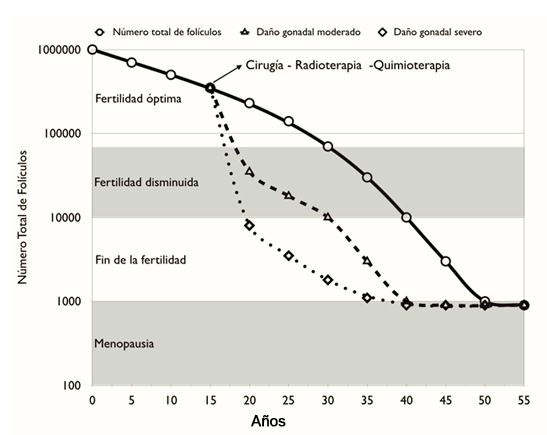
La quimioterapia y la radioterapia afectan el número total de ovocitos, cuyo efecto secundario frecuente es la infertilidad, la insuficiencia ovárica primaria y/o la menopausia anticipada (Figura 1) [11]. Este efecto puede ser por daño directo sobre los ovocitos primordiales, los folículos en desarrollo, las células de la granulosa, el estroma y/o por daño vascular [12]. Dentro de los agentes quimioterapéuticos, la ciclofosfamida es el agente alquilante que causa el mayor daño a la reserva ovárica activando los folículos primordiales en un mecanismo que se ha descrito como de burnout [13]. Otros agentes como el cisplatino y la doxirubicina afectan directamente a los ovocitos y las células de la granulosa [14]. Por otro lado, la irradiación causa un daño permanente mediante la destrucción de los folículos pequeños y en desarrollo, junto con un daño acumulativo sobre el útero y vagina [15],[16]. Todo ello genera incapacidad o discapacidad para reproducirse, osteoporosis, enfermedad cardiovascular y/o trastornos psicosociales como la depresión, lo que repercute en la calidad de vida de la paciente [17],[18].
 Tamaño completo
Tamaño completo El grado en que las noxas afectan la reserva ovárica depende de una serie de factores, incluyendo la edad de la paciente, los agentes gonadotóxicos utilizados, la dosis y la duración del tratamiento (Figura 1) [19].
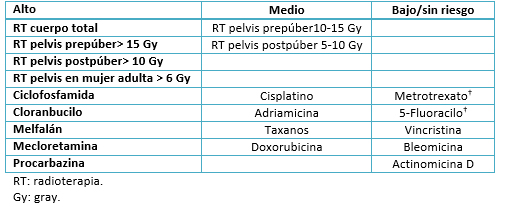
Algunos agentes se asocian con mayor frecuencia con el daño gonadal (Tabla 1). La depleción folicular alcanza casi a > 80% de las mujeres que reciben agentes alquilantes en altas dosis (por ejemplo la ciclofosfamida), irradiación total del cuerpo antes del trasplante de células madre hematopoyéticas y/o irradiación directa de los ovarios; mientras que otras terapias han demostrado ser menos deletéreas [11], [20].
Se ha observado una amplia variabilidad en el impacto sobre la reserva ovárica para los diferentes agentes gonadotóxicos. Hasta la fecha, no existen herramientas precisas que permitan dar una adecuada consejería a los pacientes o familiares que se someten a un tratamiento de radio/quimioterapia. Más aún, cabe destacar que la reserva ovárica varía enormemente de una mujer a otra [21]. En ese contexto, el asesoramiento sobre las técnicas de preservación de fertilidad debe ser ofrecido a todas las niñas y mujeres antes de ser sometidas a agentes gonadotóxicos [6],[18],[22].
 Tamaño completo
Tamaño completo b. El rol del equipo multidisciplinario
El manejo clásico del paciente con cáncer está orientado a un rápido y oportuno acceso a los tratamientos, lo que ocasionalmente dificulta una adecuada consejería sobre las opciones para preservar la fertilidad. Más aún, en la mujer, el desarrollo de las técnicas de preservación de fertilidad es un esfuerzo reciente y muchas pacientes y proveedores de la salud no están familiarizados con el rápido avance en el desarrollo de las técnicas. Esto se traduce en una baja consejería y acceso a las técnicas disponibles hoy. En países desarrollados, entre 30 y 50% de las mujeres en edad reproductiva no reciben tales técnicas al iniciar radio o quimioterapia [24]. En Chile, en un estudio aún no publicado de 153 pacientes entre 19 y 35 años sometidas a quimioterapia en el hospital Carlos van Büren de Valparaíso entre los años 2011 y 2012, mostró que 26% de las pacientes recibió una consejería adecuada y sólo 9% fue derivada a un especialista en medicina reproductiva. Estas cifras contrastan con lo recomendado por la Sociedad Americana de Oncología Clínica (ASCO) y la Sociedad Europea de Oncología Médica (ESMO), quienes señalan que todos los pacientes debieran acceder a tratamientos de preservación de fertilidad previo al inicio de su tratamiento oncológico [18],[25].
La evaluación del riesgo de la fertilidad y la selección de una estrategia individualizada para optimizar la fertilidad después del tratamiento del cáncer, son enormes retos y requieren una intensa cooperación entre el equipo médico y las pacientes [20],[26]. En este contexto, los profesionales de la salud que tratan a pacientes jóvenes contra el cáncer o patologías benignas gonadotóxicas, deben ser conscientes de los efectos adversos del tratamiento sobre la fertilidad, de las estrategias para minimizar estos efectos y de las técnicas actualmente disponibles. Esto implica informar adecuadamente a las pacientes y sus familias, facilitar la oportuna referencia a un especialista en fertilidad y adaptar los tratamientos oncológicos a los requerimientos de las pacientes en relación a sus deseos reproductivos futuros.
Por su parte, los especialistas en fertilidad deben establecer tratamientos seguros, oportunos, asequibles y a un costo racional [22]. De igual modo, una vez superado el cáncer, el equipo de salud debe considerar la consejería, supervisión y ayuda reproductiva. Por último, se debe evaluar el mejor momento para concebir, considerando los deseos de las pacientes, el riesgo de recurrencia de la enfermedad, la sobrevida teórica y el daño potencial a la descendencia producto de enfermedades genéticas transmisibles o por la propia terapia oncológica [22]. El trabajo colaborativo y multidisciplinario aquí descrito se agrupa en una naciente disciplina llamada oncofertilidad [19],[26].
c. Estrategia de preservación de fertilidad
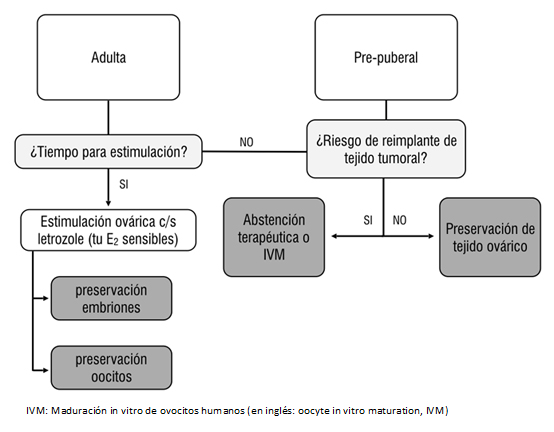
Las alternativas disponibles en la actualidad son elaboradas sobre evidencia médica del mejor nivel disponible, permiten recomendar diferentes métodos considerando la edad de la paciente, el tipo de cáncer, el tipo de tratamiento, la presencia de una pareja masculina, el tiempo disponible para antes del tratamiento gonadotóxico y la probabilidad de metástasis ovárica [18],[22] (Tabla 2 y Figura 2).
 Tamaño completo
Tamaño completo 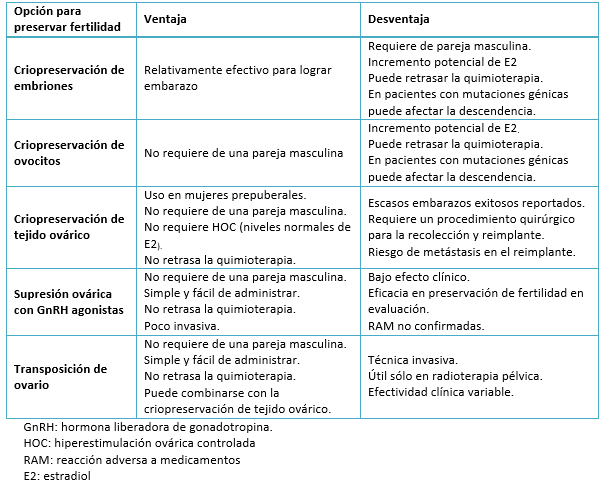 Tamaño completo
Tamaño completo 1. Criopreservación de ovocitos o embriones: son técnicas establecidas, efectivas y probadas para preservar la capacidad reproductiva. Se consideran técnicas convencionales dentro de la medicina reproductiva [22]. Ambas incorporan un periodo de hiperestimulación ovárica controlada de 9 a 14 días, cuyo objetivo es aumentar el número de ovocitos para que una vez extraídos puedan ser criopreservados o inseminados, aumentando la probabilidad futura de lograr un embarazo. La dosificación y el protocolo seleccionado se determina considerando la reserva ovárica y la sensibilidad tumoral a las hormonas femeninas [9]. Aunque hay datos contradictorios, el diagnóstico del cáncer pareciera no afectar a la reserva ovárica o la capacidad de respuesta a las gonadotropinas antes de exponerse al tratamiento gonadotóxico [27],[28].
En condiciones que apremian el inicio del tratamiento oncológico, la implementación de nuevos protocolos permite el inicio de la estimulación sin esperar la menstruación de la paciente, reduciendo el periodo de latencia desde la derivación a la recolección de los ovocitos de cuatro a dos semanas [29],[30]. Más aún, una precoz derivación sumada a la aplicación de tales protocolos ha demostrado no modificar el inicio de la quimioterapia e incluso proporcionar la oportunidad de más de un ciclo de criopreservación [31],[32],[33].
Otras modificaciones a los protocolos de estimulación han permitido reducir los niveles suprafisiológicos de esteroides sexuales observados en la estimulación convencional, aumentando la seguridad teórica de la técnica en pacientes con cáncer hormonodependientes, sin comprometer los resultados observados [34]. Estudios prospectivos con estos protocolos han demostrado, con un seguimiento de hasta cinco años, que las tasas de recurrencia y supervivencia al cáncer son similares a quienes no recibieron tratamiento de preservación de fertilidad [35],[36].
Durante décadas, la criopreservación de embriones fue el único método de preservación de fertilidad considerado no experimental por la Sociedad Americana de Reproducción (ASRM) [22]. Su seguridad y eficacia se extrapola de los tratamientos convencionales de reproducción asistida, donde se reportan miles de nacidos cada año a partir de embriones congelados. Los embriones humanos son altamente resistentes al daño por congelación, con una tasa de supervivencia e implantación de más de 90 y 30% respectivamente [9],[37]. No obstante, la criopreservación de ovocitos se considera una mejor opción, al ser aplicable en mujeres jóvenes o adolescentes, mujeres sin pareja o para quienes desean una mayor flexibilidad reproductiva. De igual modo, es de elección en quienes tienen una preocupación ética o religiosa relacionada con la disposición futura del embrión [9].
Durante la última década, se han observado importantes avances en las técnicas de vitrificación que minimizan el daño a la estructura celular por la formación de cristales de agua observado con las técnicas de congelación lenta [38]. La creciente experiencia y los avances logrados en la criopreservación permiten que los resultados reproductivos con ovocitos criopreservados/descongelados sean comparables con las tasas de ovocitos frescos sometidos a técnicas de reproducción asistida [39],[40]. En consecuencia, desde el año 2013 que esta técnica se considera estándar por las sociedades Americana y Europea de Reproducción [41],[42]. Las tasas estimadas de embarazo, una vez descongelados los ovocitos, varía según el número de gametos criopreservados y la edad de la paciente, de tal modo que cada ovocito aporta una tasa de embarazo entre 4 y 8%, reportándose tasas de embarazo promedio entre 30 y 50% [43],[44]. Existen herramientas digitales que entregan tasas de embarazo según las principales variables relacionadas (http://fertilitypreservation.org/advanced-treatments/fertility-preservation)
La criopreservación de ovocitos/embriones se desaconseja una vez iniciada la quimioterapia, debido a que la respuesta del ovario a la estimulación y la calidad de los ovocitos recuperados disminuyen tras el inicio de la quimioterapia [45]. Es conocido que la quimioterapia induce a la ruptura del ADN en los ovocitos humanos, haciendo recomendable esperar al menos seis meses antes de intentar concebir [45].
2. Criopreservación de tejido ovárico: es la única opción para preservación de la fertilidad disponible en niñas prepúberes y para mujeres que no pueden retrasar el inicio de la quimioterapia [6].
Se basa en el principio que la corteza ovárica es el reservorio de los folículos primordiales, por tanto su remoción quirúrgica, la criopreservación y posterior reimplante, permite la preservación de la función reproductiva y hormonal de las pacientes sometidas a la técnica. Desde el primer nacimiento reportado con esta técnica por Donnez en el año 2004 [46], la criopreservación de tejido ovárico se ha convertido en una técnica cada vez más utilizada para la preservación de fertilidad, reportando a la fecha al menos 60 niños nacidos vivos [47]. En Europa se realizan entre 2500 y 6500 extracciones de corteza por año [48], y su tasa de éxito reportada es de 29% por paciente reimplantada, lo que ha impulsado a líderes de opinión a considerar esta técnica no experimental [49].
En las pacientes auto-trasplantadas, se ha reportado la restauración de la actividad ovárica en el 100% de ellas, con una duración media de la función ovárica de cinco años en los casos con alta densidad folicular [47]. La seguridad de la técnica sobre la descendencia se ha demostrado en series de casos con nacidos vivos sin defectos congénitos [50]. No obstante estos avances, su uso es aún restringido al ser un procedimiento invasivo y con relativamente pocos centros médicos con experiencia en esta técnica. Los principales desafíos de la técnica incluyen el daño al tejido por isquemia, la posterior revascularización y la posibilidad teórica de la reintroducción de las células tumorales malignas [22].
Se han desarrollado guías para la correcta selección de las pacientes tributarias a esta técnica, restringiendo su uso a niñas prepúberes y mujeres:
a. Menores de 35 o 39 años.
b. Sin tratamiento gonadotóxico previo.
c. Con una oportunidad realista de supervivencia a cinco años.
d. Con riesgo de pérdida de la capacidad de reproducción por tratamiento oncológico superior al 50%.
e. Con bajo o sin riesgo de reintroducir células malignas con el reimplante.
f. Con serología negativa para infecciones de transmisión sexual.
g. Con el consentimiento informado de los padres o representantes legales [51],[52].
3. Protección de la función ovárica nativa: existen técnicas de menor efectividad que pueden ser utilizadas en forma complementaria con las ya desarrolladas. Estás técnicas se pueden diferenciar según el tipo de gonadotóxico utilizado:
i. Radioterapia. La transposición de ovario es una técnica quirúrgica en que los ovarios se mueven para distanciarse del campo de radiación. Se utiliza frecuentemente cuando se indica radiación pélvica, tal como para el cáncer cervical o de vagina. Involucra la movilización del pedículo vascular y la fijación del ovario fuera de la pelvis. La ubicación exacta para la transposición depende del tratamiento planificado y la anatomía de la paciente [9],[53]. Los resultados de la técnica son inconsistentes (entre 16 y 90% de éxito) [11], demostrándose que los ovarios reciben hasta 15% de la dosis total pélvica [15]. La técnica se asocia a complicaciones y requiere del reposicionamiento de los ovarios en la pelvis post radioterapia, a fin de facilitar el embarazo espontáneo [11]. Para mejorar las posibilidades de embarazo, se ha postulado un abordaje combinado, criopreservando la corteza de un ovario y realizando la transposición del contralateral en el mismo acto quirúrgico [54].
ii. Quimioterapia. Recientemente se ha utilizado la hormona liberadora de gonadotropina (GnRH) en forma previa o durante la quimioterapia, como una forma de reducir los efectos gonadotóxicos del tratamiento del cáncer. Los agonistas de hormona liberadora de gonadotropina bloquean la actividad del eje hipotálamo-hipofisario-gonadal, suprimiendo los niveles de gonadotropina a niveles prepuberales. A pesar de que algunos estudios recientes han demostrado cierto grado de protección gonadal mediante la medición de resultado intermedios como la tasa de amenorrea, las medidas del efecto no han tenido impacto sobre el test de reserva ovárica fidedignos como la hormona antimülleriana (AMH) o el conteo de folículos antrales, ni han demostrado mejorar las tasas de embarazo [55],[56],[57],[58]. El comité de la Sociedad Americana de Reproducción, la Sociedad Americana de Oncología Clínica y numerosos autores, desaconsejan el uso de análogos de la hormona liberadora de gonadotropina como protección gonadal en pacientes con cáncer. Su uso debe considerarse sólo como una alternativa complementaria a tratamientos con efectos reproductivos probados [18], [22],[49].
d. Otras técnicas emergentes:
i. Criopreservación de ovocitos tras maduración in vitro. En cualquier etapa del ciclo menstrual se puede observar una cohorte de folículos antrales pequeños [10]. Estos folículos se pueden recuperar a través de una aspiración transvaginal, en un ciclo natural o tras una breve estimulación ovárica para ser congelados¸ habitualmente después de la maduración in vitro [19]. De esta manera, esta técnica es una opción para las mujeres que no tienen suficiente tiempo o presentan una contraindicación para completar un ciclo de estimulación ovárica. A pesar de que más de 2000 niños han nacido gracias al uso de ovocitos frescos madurados in vitro, muy pocos nacidos vivos han sido reportados con el uso de ovocitos criopreservados tras la maduración in vitro [19],[59],[60]. La maduración in vitro de ovocitos se encuentra en fase experimental y todavía necesita un mayor desarrollo antes de poder ofrecerse como una técnica convencional [22].
ii. Cultivo de folículos preantrales in vitro. Los folículos primordiales corresponden al reservorio de ovocitos en el ovario. Su desarrollo demora entre dos y tres ciclos menstruales [10],[61], por lo que su cultivo in vitro representa un desafío biotecnológico mayor [19],[62],[63]. A partir de folículos obtenidos de tejido ovárico humano y animal, se han desarrollado diversos métodos para el crecimiento in vitro de folículos. Su objetivo es reanudar la función ovárica reproductiva, junto con evitar el riesgo de reintroducir células malignas [62],[64]. Hasta la fecha, los avances en el cultivo y trasplante de folículos humanos han permitido el desarrollo de folículos pequeños y preantrales, sin embargo, no ha resultado en nacidos vivos [64]. Esta técnica se encuentra en fase experimental, aunque constituye una alternativa prometedora al reimplante de tejido ovárico, al evitar el riesgo de reintroducción de células malignas [60].
Conclusión
Los recientes avances en los tratamientos oncológicos permiten una alta sobrevida de las niñas y mujeres jóvenes afectadas por enfermedades malignas. Sin embargo, tales terapias deterioran la función gonadal y secundariamente la fertilidad futura de estas pacientes, constituyendo un problema emergente de salud.
Actualmente, existen tratamientos de preservación de fertilidad eficientes para los diferentes escenarios clínicos posibles, dando a las pacientes con cáncer la oportunidad de un embarazo exitoso cuando hayan superado su enfermedad. A pesar de tales avances, sólo una pequeña fracción de pacientes expuestos a tratamientos gonadotóxicos es referida a especialistas para recibir tratamientos oportunos y efectivos. La falta de conocimiento, la baja disponibilidad y cobertura por las aseguradoras son barreras importantes a superar antes de ver cambios significativos en la materia.
De igual forma, la conformación de equipos multidisciplinarios que incorporen la visión oncológica, reproductiva, apoyo psicosocial adecuado y las preferencias de los pacientes, son fundamentales para atender las necesidades de quienes se enfrentan a tratamientos gonadotóxicos.
El impulso y los recientes avances en la oncofertilidad presentan dificultades. No obstante, su progresiva implementación es una necesidad real, y una obligación moral y legal para los centros de derivación oncológicos. En el futuro próximo, los requerimientos de tratamientos de preservación de fertilidad por razones médicas y sociales serán crecientes. En este contexto, el trabajo colaborativo entre los profesionales de la salud, las pacientes y las autoridades será vital para poder dar respuesta a este desafío.
Notas
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos intereses del ICMJE traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que recibieron apoyo financiero del Programa de Mejoramiento Institucional PMI-UVA 1402.

