Cursos
← vista completaPublicado el 1 de julio de 2006 | http://doi.org/10.5867/medwave.2006.06.3519
Diagnóstico y manejo nutricional de pacientes con síndrome de Down
Diagnosis and nutritional management of patients with Down syndrome
Resumen
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Desafíos en Nutrición y Alimentación, organizado por la Sociedad Chilena de Pediatría entre los días 26, 27 y 28 de abril de 2006.
Directores: Dr. Francisco Moraga y Dr. Eduardo Atalah.
Introducción
El síndrome de Down fue descrito por el Dr. John Langdon Down (1828-1896), Director del Asilo para Retrasados Mentales de Earslwood, en Surrey, Inglaterra, en un artículo titulado Observaciones en una clasificación étnica de idiotas (1), acuñándose el término mongolismo, que actualmente está en desuso. Desde esa época hasta hoy se ha investigado mucho acerca del síndrome de Down y sus problemas asociados. En Chile, hasta hace no más de 15 años, los pacientes con síndrome de Down con cardiopatía no se intervenían.
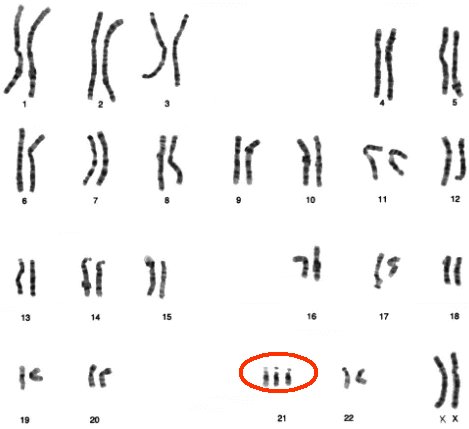
La incidencia del síndrome de Down en Chile se estima en 19,2/10.000 nacidos vivos, lo que significa que cada año nacen entre 400 y 420 niños con este síndrome (2), cuyo fenotipo es clásico (Fig.1) y está dado por tres posibles genotipos, de los cuales el más frecuente es la trisomía 21 total, además de la trisomía parcial (o mosaicismo) y la traslocación. En la Figura 2 se muestra un cariotipo con tres cromosomas 21, dado que este cromosoma es pequeño, es factible la sobrevida de una proporción importante de los pacientes portadores.
 Tamaño completo
Tamaño completo Figura 1. Fenotipo del síndrome de Down
 Tamaño completo
Tamaño completo Figura 2. Cariotipo de paciente con síndrome de Down: trisomía 21, 47 XX, +21.
El síndrome de Down se asocia a varios cuadros clínicos: 50% de los niños presentan alguna cardiopatía con compromiso funcional variable, que en algunos casos sólo requiere de tratamiento farmacológico, pero en otros es preciso una intervención quirúrgica para corregir el defecto y mantener con vida al paciente. El síndrome de Down se asocia también a patologías del área gastrointestinal, como estenosis y atresia duodenal, ano imperforado, constipación y enfermedad de Hirschsprung, así como a ciertas enfermedades que aparecen con la evolución, como la enfermedad celíaca. También se asocia con frecuencia a trastornos de la visión (hipermetropía, miopía, cataratas) y audición (hipoacusia de conducción). Asimismo es necesario investigar el hipotiroidismo en forma precoz. Otras patologías asociadas son: infecciones respiratorias; apnea obstructiva del sueño; leucemia mieloide; luxación congénita de caderas; flaccidez muscular, etc.
Antropometría y composición corporal
Se dispone de escasa información sobre la composición corporal de los pacientes con síndrome de Down, pero se sabe que ellos se caracterizan por: 1) talla baja, con estatura promedio entre 1,45 y 1,50 m en la edad adulta, es decir, muy por debajo de la estatura promedio normal; 2) estirón puberal precoz, que se inicia a los 9,5 años en niñas y a los 11 años en niños; y 3) sobrepeso y obesidad, muy frecuentes en la adolescencia y adultez.
La evaluación nutricional de estos pacientes se realizaba según los estándares antropométricos utilizados en la población sana, y se les diagnosticaba desnutrición y talla baja. Sin embargo, al igual que para muchos cuadros mórbidos se desarrollaron estándares propios de crecimiento en distintos países como España, Estados Unidos, Suecia, Reino Unido, Irlanda, Holanda e Italia (3, 4, 5, 6, 7, 8, 9). Cada tabla se ha diseñado con distintas metodologías y la elección de la más adecuada, será aquella que pueda guiar la expresión del máximo potencial de desarrollo de estos niños.
Las tablas que más se utilizan son las de la Fundación Catalana de Síndrome de Down, que tiene dos versiones (1998 y 2004) (3, 4) y las tablas de Cronk (5), que considera la población estadounidense, y publicadas en 1978 y 1988. Las curvas de crecimiento suecas (6) se obtuvieron de un estudio longitudinal y transversal, con 4.832 mediciones en 354 pacientes, de los cuales 151 eran mujeres y excluyéndose a los pacientes que utilizaban hormonas de crecimiento. Con estos datos se confeccionaron solamente gráficos que expresan en desviaciones estándar peso para la edad, talla para la edad, perímetro craneano para la edad e índice de masa corporal (IMC) para la edad. La tabla sueca es la única que grafica el IMC.
En el estudio realizado en el Reino Unido e Irlanda (7) se realizaron 5.913 mediciones en 1089 pacientes, excluyéndose a todos los pacientes con patología cardíaca, prematuros o aquellos que fallecen durante el seguimiento: en la práctica se dejaron los pacientes con síndrome de Down sanos. Es probable que por eso sea una de las tablas más exigentes. También está disponible en percentiles y los parámetros que considera son: peso, talla y perímetro de cráneo para la edad. El grupo de Cremers, en Holanda, (8) realizó un estudio transversal en pacientes hasta los 20 años de edad, con 2.045 mediciones en 295 individuos sin morbilidad asociada, de las cuales se obtuvieron gráficos en percentiles, pero sólo para los parámetros peso y talla para la edad.
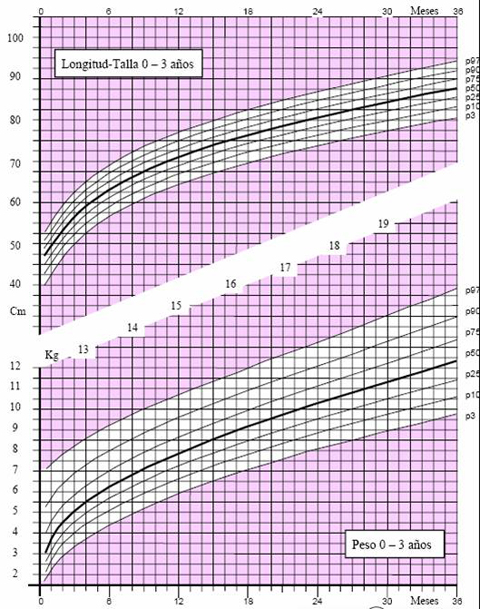
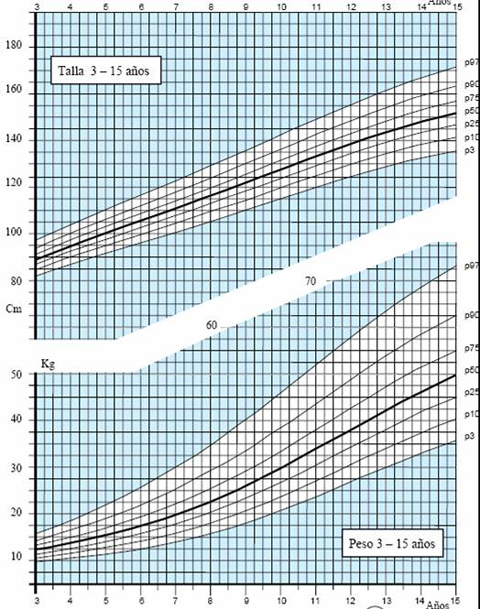
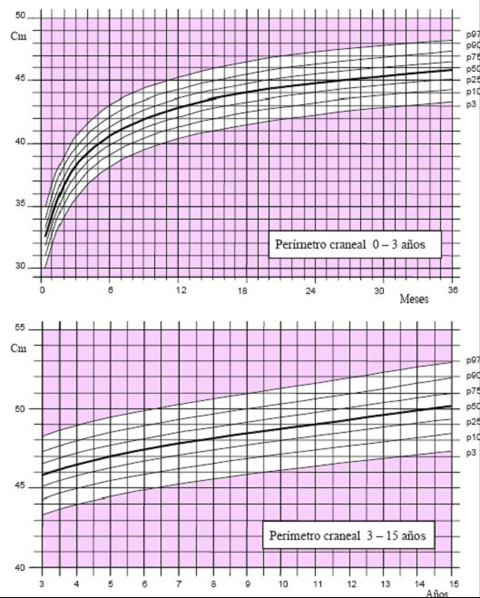
Las tablas de crecimiento de los niños españoles con síndrome de Down, desarrolladas por la Fundación Catalana Síndrome de Down, datan de 1998 (3) y se incluyen en el libro “Estándares Antropométricos para Evaluación del estado Nutritivo”, de Gladys Barrera, publicado en los años 2004 y 2006 por INTA. Estas tablas se inician a los 2 meses de vida, por lo que es muy difícil extrapolar la información para determinar el estado nutricional de un niño antes de esa edad. En el 2004, la Fundación desarrolló tablas con percentiles, que permiten determinar con exactitud el estado del niño. Para confeccionar las curvas de crecimiento del año 2004 (4) se efectuaron 1.718 mediciones, 763 de ellas en mujeres y se excluyó a los pacientes con patologías que afectan el crecimiento, como cardiopatías, hipotiroidismo, etc. El gráfico de 2004 comienza desde el primer mes de vida y muestra los percentiles 3, 10, 25, 50, 75, 90 y 97 en los distintos parámetros evaluados en niños y niñas, como peso y longitud, peso y talla y perímetro de cráneo (Figs. 3 a 5).
 Tamaño completo
Tamaño completo Figura 3. Peso y longitud en niñas de 0 a 3 años (4)
 Tamaño completo
Tamaño completo Figura 4. Peso y Talla en niños de 3 a 15 años (4)
 Tamaño completo
Tamaño completo Figura 5. Perímetro craneal en niñas de 0 a 15 años (4)
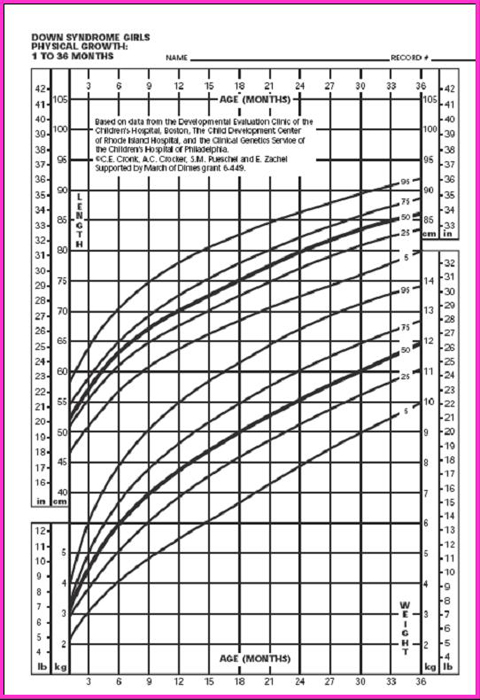
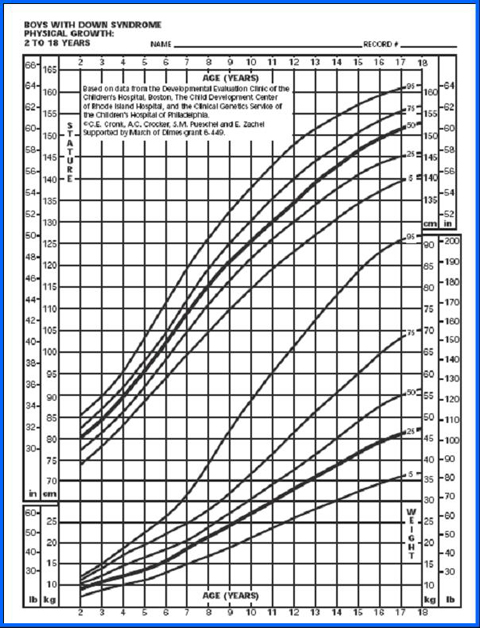
La tabla de Cronk (5), que se utiliza bastante, permite diagnosticar el estado nutricional desde el mes de vida hasta los 18 años. Hubo un estudio anterior, de 1978, que cubrió hasta los 3 meses, basado en 4.650 observaciones realizadas en 730 niños, pero sin excluir a ningún paciente; en él se clasificó a los niños cardiópatas en tres categorías, según si la cardiopatía congénita no requería tratamiento, si necesitaba tratamiento médico o si tenía indicación de cirugía. Los parámetros se graficaron en percentiles de peso para la edad, talla para la edad y perímetro de cráneo para la edad (Figs. 6 y 7), pero no se confeccionó ninguna tabla ni gráfico con la relación peso/talla.
 Tamaño completo
Tamaño completo Figura 6. Peso/edad y talla/edad en niñas de 1 a 36 meses (5)
 Tamaño completo
Tamaño completo Figura 7. Peso/edad y estatura/edad en niños de 2 a 18 años (5)
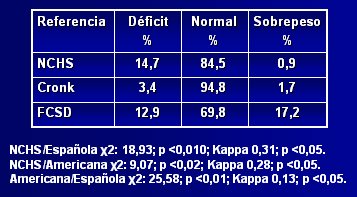
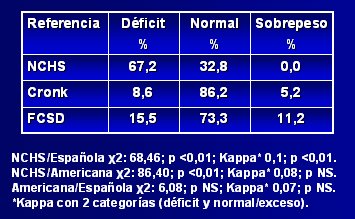
Respecto a la adecuación de estas curvas de crecimiento a la población con síndrome de Down chilena, Pinheiro y su grupo publicaron en 2003 un estudio (10) en el que compararon la referencia estadounidense con la catalana, para determinar cuál era más adecuada para la población chilena, aplicando el patrón de referencia del NCHS (National Center for Health Statistics) para observar la distribución. En la Tabla I se aprecia que, según el NCHS, alrededor de 15% de los niños afectados presentan déficit nutricional, 85% son normales y 0,9% tienen sobrepeso, a pesar de que una proporción importante de niños chilenos con síndrome de Down son obesos; por lo tanto, esta referencia subestima el estado nutricional, al igual que la tabla de Cronk; en cambio, la tabla catalana diagnostica 17% de sobrepeso, cifra que parece ser más representativa de la población chilena. Al aplicar el índice kappa se encontró que había escasa correlación entre las tres referencias, pero los resultados obtenidos con la referencia catalana se acercaban mucho más a una curva gaussiana. El índice talla/edad tuvo un comportamiento muy parecido al del índice peso/edad (véase Tabla II). Los autores concluyeron que, si bien los resultados no son categóricos, las tablas catalanas se podrían considerar como más adecuadas para la población chilena, porque fueron diseñadas a partir de una población latina. Los autores hacen hincapié en la necesidad de realizar un estudio para evaluar la composición corporal en este grupo de pacientes.
 Tamaño completo
Tamaño completo Tabla I. Distribución nutricional según la relación peso/edad, utilizando tres referencias antropométricas (10)
 Tamaño completo
Tamaño completo Tabla II. Distribución nutricional según la relación talla/edad utilizando tres referencias antropométricas (10)
Actividad física
La actividad física de los niños con síndrome de Down sigue un patrón muy particular y está relacionada el desarrollo sicomotor; así, estos niños se caracterizan por un menor desarrollo muscular, menor potencia muscular y desarrollo más tardío de la marcha. Además, la sobreprotección y el aislamiento social, que incluso puede llegar a una verdadera reclusión, permiten explicar en parte los altos porcentajes de obesidad. Asimismo, reacciones de duelo inadecuadas de los padres pueden llevar al total abandono de estos pacientes y al desarrollo de un profundo compromiso nutritivo y sicomotor. En la actualidad se promueve la estimulación temprana, con el objeto de lograr un satisfactorio desarrollo sicomotor, más próximo al del niño sano. De hecho, los niños estimulados precozmente caminan alrededor del año y medio, en promedio, o sea, sólo se retrasan 6 meses en comparación con los niños sanos, mientras que un niño con síndrome de Down que no recibe estimulación alguna camina recién a los 3 años de edad.
Los patrones de actividad física han sido escasamente estudiados en los niños con síndrome de Down. En 2006 se publicó un estudio (11) que compara la actividad física de estos niños con la de su hermano. Los niños debían tener entre 3 y 10 años, un percentil de IMC entre 5 y 95 y los criterios de exclusión fueron: cardiopatía congénita que hubiese requerido cirugía con circulación extracorpórea; anomalías gastrointestinales que hubiesen requerido resección u otra intervención médica; leucemia; cáncer; hipotiroidismo u otro estado que afectara el crecimiento. Se utilizó el acelerómetro Actitrac (R) durante 7 días consecutivos en cada paciente y su hermano. El grupo de niños con síndrome de Down (n=28) y el grupo de los hermanos sanos (n=30) fueron comparables, excepto en la edad, índice peso/talla e IMC. Se observó que los niños con síndrome de Down realizaban menos tiempo actividad física vigorosa que sus hermanos sanos, 50 minutos/día versus 70 minutos/día; y los períodos de actividad vigorosa eran más breves, 2,5 minutos versus 5 minutos; y no hubo diferencia significativa en el tiempo de actividad física leve a moderada, entre ambos grupos. El estudio concluye que los niños con síndrome de Down se mueven poco y su actividad física vigorosa es de menor calidad y cantidad que la de los niños sanos, lo que puede constituir un factor determinante para desarrollar obesidad.
Prevención prenatal
James planteó, en 1999, que podría haber una relación entre la deficiencia del metabolismo del ácido fólico y la no disyunción meiótica, lo que determinaría que uno de los pares cromosómicos permaneciera en la célula germinal (12), hipótesis que originó numerosas investigaciones. Según la investigadora, una mutación en el nucleótido de la enzima metiltetrahidrofolato reductasa (MTHFR) sería la causa de esta alteración metabólica, ya que las madres de niños con síndrome de Down presentan una alteración del metabolismo del folato, la que se objetivó por la citotoxicidad al metrotrexato, los niveles de concentración de metionina y la relación entre metionina y homocisteína. El estudio demostró que las madres que presentaban la mutación 677-C tenían un riesgo 2,6 veces mayor de tener un hijo con síndrome de Down que las madres normales (que no presentaban la mutación). Así, el alelo C/C de la MTHFR es el homocigoto normal; el heterocigoto C/T tiene 35% menos de actividad y el homocigoto T/T es 70% menos activo. La enzima MTHFR convierte la 5,10-metilentetrahidrofolato en 5-metilentetrahidrofolato, debido a lo cual, un grupo metilo se transfiere a la homocisteína y después a la metionina (adenosilmetionina o SAM), la que finalmente entrega el grupo metilo al ADN (Fig. 8). A este nivel se podría presentar la alteración y, como consecuencia, los dos cromosomas 21 permanecerían en una de las células germinales y la otra célula germinal quedaría sin este cromosoma.
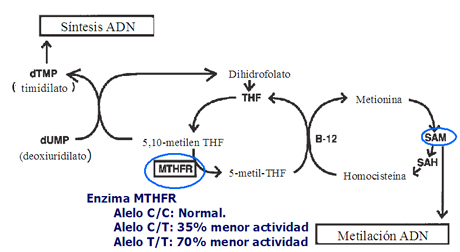 Tamaño completo
Tamaño completo Figura 8. Actividad del MTHFR en la síntesis y metilación del ADN
En 2006, Guent-Rodriguez demostró que los polimorfismos de la MTHFR presentan una distribución mundial muy heterogénea (13) y algunos predominan en zonas determinadas; por ejemplo, en Ciudad de México, el alelo mutante T/T predomina más que en África y éste es más frecuente en el norte que en el sur de Europa. Esta mayor prevalencia se observa en áreas en que las dietas son ricas en folato, por lo que se piensa que habría una compensación entre el gen y el nutriente, es decir, entre este polimorfismo y el folato, por lo que existiría una ventaja selectiva del alelo T/T en áreas ricas en folato.
Czeizel observó que cuando se suplementaba a las madres con dosis altas de ácido fólico (alrededor de 6 mg/día) y hierro (150 a 300 mg de sulfato ferroso), disminuían los casos de síndrome de Down, en comparación con las mujeres que no habían recibido suplemento; en cambio, no logró demostrar un efecto protector de las vitaminas antioxidantes (14). Además postuló que la mutación de otra enzima, la metionina sintasa reductasa (MTRR), cumpliría el mismo efecto que la MTHFR, pero sin resultados categóricos. Podría señalarse que estas dos enzimas (MTHFR y MTRR) podrían afectar la meiosis y específicamente la separación de los cromosomas en la reducción.
En un estudio publicado en 2000 (15) se señala que existe una asociación entre polimorfismos de MTRR o de MTHFR con el síndrome de Down, y que las madres portadoras de alelos heterocigotos o mutados tendrían mayor riesgo de tener hijos con esta trisomía. Cuando coexisten mutaciones de ambas enzimas, el riesgo de tener un niño con síndrome de Down es hasta cuatro veces mayor, en comparación con las mujeres que tienen las dos enzimas sin alteraciones.
Terapia nutricional
La terapia nutricional está incluida en la supervisión de la salud del niño con síndrome de Down. Es necesario elegir un estándar antropométrico adecuado. Durante la consulta de supervisión de salud y seguimiento es preciso orientar hacia hábitos alimentarios y de actividad física saludables e impulsar su ingreso a sistemas de estimulación temprana. El plan nutricional se debe situar en los problemas de salud actuales del paciente; por ejemplo, muchos pacientes necesitan alcanzar un peso adecuado para enfrentar en forma adecuada una cirugía cardíaca. Es importante definir adecuadamente el aporte energético y proteico, y la única manera de evaluarlo es por medio del patrón de crecimiento del paciente. Hay muchas alternativas de alimentación, como la leche materna, la fórmula láctea y las comidas, cuando corresponda introducirlas. Las rutas de alimentación pueden ser la vía oral, o utilizar una sonda gástrica e incluso realizar una gastrostomía, si fuera necesario.
En un estudio italiano se entrevistó a madres de niños con síndrome de Down atendidos en hospitales universitarios, para determinar el estado de la lactancia natural (16), en un universo de 560 niños, de los cuales, 246 estaban todavía en la Unidad de Neonatología. Se encontró que 70% de los niños que debieron ser hospitalizados y 46% de los que no se hospitalizaron, no recibían leche materna; y la duración de la lactancia materna era de 54 días (desviación estándar de ± 111 días), en especial en los niños que se hospitalizaron en Neonatología. Así, 57% de los niños con síndrome de Down no recibía leche materna. Las frecuentes enfermedades del niño; la depresión y frustración que sentían las madres por haber tenido un niño con síndrome de Down; el miedo de tener escasa producción láctea; y la succión débil de los niños, eran las razones señaladas por las madres de estos niños.
Conclusiones
Para diseñar un plan nutricional, en un paciente con síndrome de Down, se debe: evaluar los problemas de salud actuales, incluido el estado nutritivo del paciente, comparando con el estándar antropométrico más adecuado; establecer el aporte energético y proteico más adecuado; y determinar los tipos de alimentos y la vía de alimentación que se va a utilizar. Estos niños deben recibir los mismos suplementos que los niños sanos. Adicionalmente se debe impulsar la incorporación de los lactantes a programas de estimulación temprana, así como la creación de hábitos de vida saludables en lo referente a la alimentación y actividad física, con el fin de prevenir las enfermedades crónicas de la edad adulta y buscar y tratar en forma adecuada y precoz las patologías asociadas.
La gran duda, que aún no se logra resolver, es la posibilidad de prevenir que una madre tenga hijos con síndrome de Down, mediante medidas como la administración de una dosis alta de folato, dosis altas de hierro o vitaminas antioxidantes. Las investigaciones podrían llegar a responder esta duda en el futuro, pero el desafío actual es lograr que estos niños desarrollen al máximo su potencial genético.

