Congresos
← vista completaPublicado el 1 de abril de 2006 | http://doi.org/10.5867/medwave.2006.03.1011
Interferones pegilados en hepatitis C
Pegylated interferon in hepatitis C
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el XXXII Congreso Chileno de Gastroenterología, realizado en la ciudad de Pucón entre los días 23 al 25 de noviembre de 2005. El evento fue organizado por la Sociedad Chilena de Gastroenterología.
Presidente del Congreso: Dr. Claudio Navarrete.
Introducción
Los médicos deben tener una visión objetiva de los interferones pegilados (IFN-PEG), aceptar sólo lo que se base en datos válidos y evitar que la presión de la industria influya en sus decisiones. Se han realizado estudios de registro y comparaciones a partir de ellos, a pesar de que los diseños y las poblaciones no eran comparables entre sí, sobre los siguientes aspectos:
- datos demográficos y geográficos
- porcentaje de fibrosis y cirrosis
- porcentaje de pacientes con genotipos 1 con alta carga viral (CV)
- diferentes criterios de reducción de dosis y D/C
- metodología de PCR: NGI versus Amplicor
- dosificación de ribavirina (RBV)e interferón pegilado (PEG): ajustados al peso o no.
No conviene comparar resultados de estudios que no son aleatorios ni comparables entre sí, por ejemplo, porque utilizan carga viral distinta. Por eso, en la actualidad hay discusiones y controversias sobre la relación entre farmacocinética y farmacodinamia, versus la eficacia antiviral; y sobre la eficacia comparativa a largo plazo entre el INF PEG alfa 2a y el 2b. En cambio, no hay discusiones sobre su estructura físicoquímica, metabolismo ni farmacocinética.
Estructura química
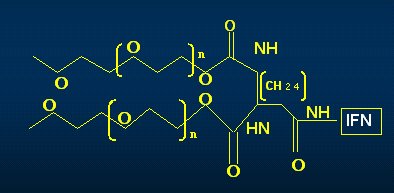
El INF alfa 2a está unido a una molécula de polietilenglicol (PEG) que pesa 40 kDa; este mayor peso molecular otorga al compuesto una serie de beneficios en cuanto a la cinética: por ejemplo, su vida media es superior a la del INF alfa 2b (Fig. 1). Otro aspecto interesante de la estructura es que el isómero por medio del cual el pegilado se une al interferón es un compuesto ramificado y la lisina es el isómero prevalente (Fig. 1). El INF alfa 2b está unido a una molécula de PEG mucho más pequeña, de 12 kDA, cuya cinética muy desfavorable, en comparación con el IFN PEG alfa 2a. El isómero por medio del cual se une el interferón con el pegilado es de histidina (Fig. 2). Estas dos características: el tamaño de la molécula de PEG y el isómero con el cual se conjuga el pegilado con el INF, son muy importantes, como se verá a continuación.
 Tamaño completo
Tamaño completo Figura 1. Estructura química del PEG IFN alfa 2a (Hadziyannis S et al. Expert Opin. Pharmacother, 2003).
 Tamaño completo
Tamaño completo Figura 2. PEG INF alfa 2b: caracterización físicoquímica.
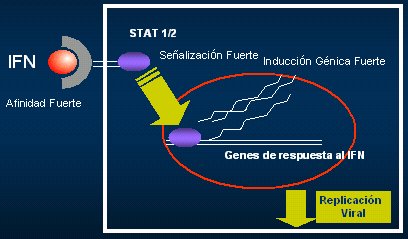
Para que el interferón ejerza un efecto antiviral, necesita unirse a su receptor en la membrana (Fig. 3); si esta unión es adecuada, genera una señal por distintas vías, para inducir en el núcleo la producción de genes y, a su vez, de proteínas, las proteínas que van a generar el estado antiviral de la célula; por lo tanto, lo que aparece en la sangre no se condice necesariamente con lo que sucede a nivel intracelular. Cuando a esto se le agrega un fármaco pegilado, es decir, que está unido a un salvavidas que le permite flotar más en el plasma, el efecto va a ser más prolongado, pero la pregunta que surge es si esto influye o no en la calidad de la interacción con el receptor.
 Tamaño completo
Tamaño completo Figura 3. Transducción de la señal del interferón alfa (Grace M, Cutler D, Antivir Chem Chemother 2004 Nov;15(6):287-97. Grace M. et al, Expert Opin. Drug Deliv 2005).
Hay distintos fármacos pegilados. El impacto biológico de la pegilación depende de la vida media plasmática (cuanto más prolongada, el efecto es mayor) y de la calidad de la interacción con el receptor. Al mismo tiempo, estos dos factores están condicionados por el tamaño de la proteína (molécula del PEG), el tipo de isómero de conjugación y el número de polímeros (Wyss et al., Current Pharmaceutical Design, 2002). Dicho de otra forma, la actividad del INF está determinada por la calidad de la interacción con su receptor, y el tamaño de la molécula del PEG y el tipo de isómero impactarían en dicha interacción. Varios experimentos in vitro demuestran que lo anterior es cierto y que la actividad antiviral in vitro difiere según el tamaño y el tipo del isómero con el que se conjuga el INF madre. En los trabajos presentados por los laboratorios, la actividad antiviral in vitro varía entre uno y otro, pero, como ya se dijo, los datos no son comparables (Bailon et al. Bioconj Chem 12:195 (2001); Foser et al, Prot Exp Purif 30:78 (2003).
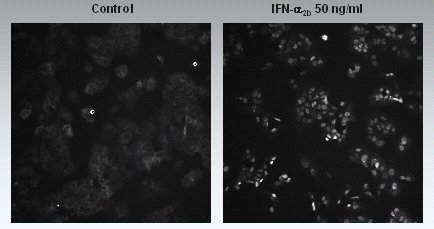
En el estudio comparativo de Grace, el objetivo fue evaluar si el isómero de conjugación y el tamaño de la molécula de PEG tienen algún impacto en la eficacia del INF alfa, mediante alteraciones en las señales intracelulares de la vía JAK/STAT; es decir, en la translocación o pasaje del STAT desde el citoplasma al núcleo; además, se determinó la potencia antiviral o antiproliferativa in vitro. La traslocación del STAT se determina por la mayor marcación de éste dentro del núcleo (Fig. 4).
 Tamaño completo
Tamaño completo Figura 4. Estudio de la traslocación del STAT en HuH-7: se incuban células con IFN alfa con diferentes isómeros y se miden, tanto en citoplasma como en el núcleo.
Cuando Grace comparó el mismo INF alfa 2b unido a moléculas de PEG de distintos tamaños, observó que, cuanto menor era el tamaño de la molécula, mayor era la eficacia in vitro, igual que cuando el isómero era de histidina, en comparación con el de lisina. Cuando analizó la capacidad antiproliferativa o inhibición del virus in vitro, observó que la molécula de menor tamaño también tenía mayor eficacia (Fig. 5). En suma, este autor concluyó que el sitio y tamaño de la pegilación impactan en la traslocación de la molécula del STAT y en los modelos de protección antiviral utilizados, y que el mayor tamaño del PEG se asocia con menor actividad antiviral in vitro; pero el significado clínico de estos hallazgos no se ha determinado.
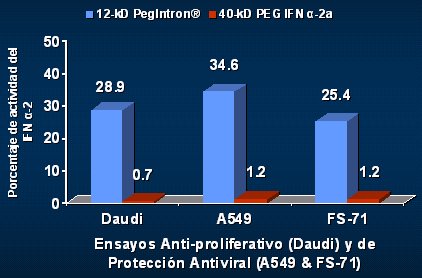 Tamaño completo
Tamaño completo Figura 5. El PEG INF alfa 2b 12kD es 25 veces más activo que el PEG IFN 2a 40kD in vitro (Grace M et al, AASLD 2003, Abstract 1928).
IFN PEG alfa 2b versus IFN PEG alfa 2a
En 2004, en la reunión de Boston, presentamos un trabajo controlado, aleatorio y doble ciego, aunque con una muestra reducida, en el que se intentó proyectar estos resultados a la clínica. Se comparó el efecto de la monoterapia con ambos interferones en dosis estándar (1,5 ug/kg de alfa 2b y 180 ug/kg de alfa 2a por semana), administrados durante 29 días; luego se agregó ribavirina, en dosis de 13 mg/kg, entre el día 30 y el día 57; y se evaluaron las mismas variables del trabajo anterior, pero in vivo. Se trató de verificar si estas moléculas inducían genes con la misma potencia al actuar sobre el receptor y si esta potencia tenía relación con la actividad antiviral in vivo. Para ello se midió la cinética, la farmacodinamia y la actividad antiviral del fármaco. Las poblaciones evaluadas fueron homogéneas en cuanto a edad, sexo, raza, sitio de origen, peso y genotipos (todos eran genotipo 1); también fueron homologables desde el punto de vista humoral, ya que las transaminasas, la citopenia y la carga viral fueron semejantes. De todo esto, lo más importante es que la carga viral y el genotipo fueron similares.
Cuando se midió la cinética del fármaco, se comprobó que la exposición a la droga fue al menos 16 veces mayor con el INF PEG alfa 2a, cuando se midió en la primera semana; como es un fármaco ajustado al peso del paciente, el área de exposición fue mucho más pareja que en el caso del otro fármaco, cuya discordancia en función del peso era muy superior, pero el resultado fue similar a lo que se describe en la literatura; es decir, que la exposición al fármaco es mayor con el alfa 2a (Fig. 6).
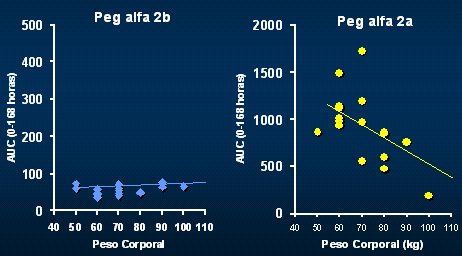 Tamaño completo
Tamaño completo Figura 6. Peso corporal y exposición al PEG IFN alfa 2a: exposición 16 veces mayor.
Al analizar los genes, se escogió la serie más conocida en cuanto a los mecanismos de acción antiviral: PKR, IP-10, ISG-15, 2’5’OAS y el gen ISG-54. Se comparó entre respondedores y no respondedores, y se observó que la inducción genética era superior en los respondedores, en forma estadísticamente significativa. Cuando se compararon ambos interferones se observó que, en la mayoría de los casos, estos genes se inducían con mayor eficacia en los pacientes que recibieron el interferón alfa 2b. Estos resultados no se obtuvieron midiendo sólo un nivel, sino que haciendo un área bajo la curva en varios puntos, durante las primeras 72 horas (Fig. 7).
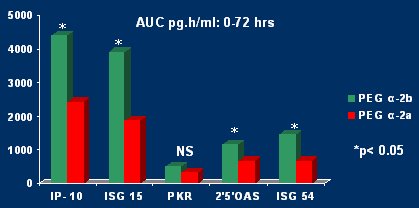 Tamaño completo
Tamaño completo Figura 7. Respuesta de genes del IFN PEG alfa 2b versus alfa 2a.
También se midió la neopterina como marcador inespecífico de la respuesta inmunológica en estos pacientes; esta molécula se utiliza como marcador en enfermedades inmunológicas y para detectar rechazo. Los resultados fueron similares a los de la inducción genética: la inducción de neopterina fue mayor en los respondedores que en los no respondedores y la inducción fue mayor con INF alfa 2b que con alfa 2a (Fig. 8).
 Tamaño completo
Tamaño completo Figura 8. Inducción de neopterina: PEG alfa 2b versus alfa 2a.
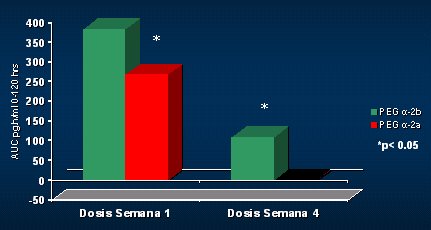
La virología se evaluó como el peak máximo de reducción en la semana 1 y en la semana 4, y como el área bajo la curva de reducción al cabo de toda la semana, para ver si se encontraba una mejor manera de medir el volumen de erradicación del virus durante la primera semana. En la primera semana, período en el que no se administraba rivabirina, la potencia antiviral del INF alfa 2b fue mayor que la del alfa 2a y este efecto no fue transitorio, ya que en la semana 4 se mantuvo el mismo patrón; en los pacientes que recibieron IFN PEG alfa 2b, el peak máximo fue aún mayor, lo mismo que el área bajo la curva (Fig. 9). Al analizar las curvas tradicionales en distintos puntos, se puede ver que, con la monoterapia, al final del primer mes la curva es diferente y la diferencia se potencia cuando se agrega la ribavirina (Fig. 10).
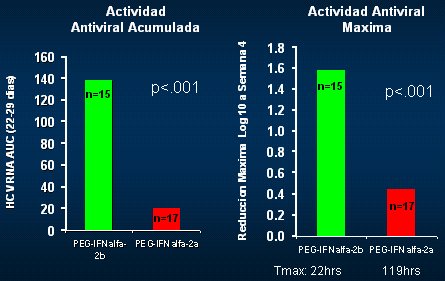 Tamaño completo
Tamaño completo Figura 9. Actividad antiviral en la semana 4.
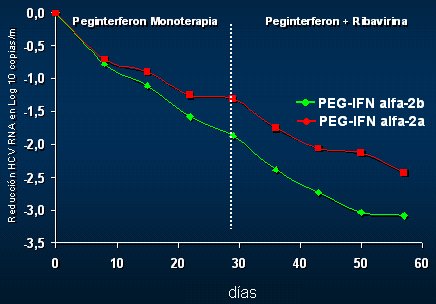 Tamaño completo
Tamaño completo Figura 10. PEG IFN alfa 2b versus PEG IFN alfa 2a: reducción media de la carga viral en la semana 8.
También se puede analizar lo anterior desde el punto de vista del porcentaje de pacientes respondedores en la semana 8. En este estudio, la definición de respondedor fue artificial, porque se consideraron sólo dos meses de tratamiento, pero se definió como el paciente cuya carga viral caía más de dos logaritmos. La cifra fue de 72% con 2b y 44% con 2a.
En cuanto a seguridad y tolerancia, en la Figura 11 se puede ver que la magnitud de la leusopenia fue mayor con el IFN PEG alfa 2a, lo que no tiene explicación, porque el efecto biológico sería mayor con el alfa 2b. Por lo tanto, quedaron algunos aspectos inconclusos.
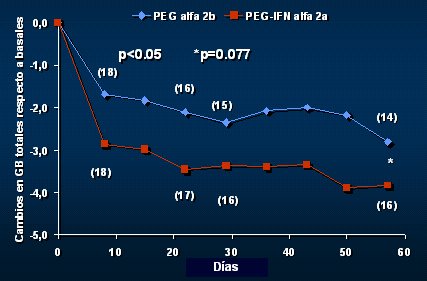 Tamaño completo
Tamaño completo Figura 11. Leucocitos totales: comparación entre PEG IFN alfa 2b y 2a.
Conclusiones
La interpretación de este estudio se debe hacer con cautela; pero, al menos, se confirmó lo que señaló Grace, en el sentido de que el tamaño y el sitio de pegilación impactan en la inducción de genes de respuesta al IFN. En este estudio, el INF PEG alfa 2b sería más eficaz en la inducción de genes de respuesta, lo que plantea mejor interacción con su receptor específico (INFAR). A las ocho semanas, la cinética viral fue diferente: el área bajo la curva y la concentración máxima fueron superiores con el alfa 2b.
El sitio de unión y el tamaño de la molécula del PEG podrían tener importancia porque el isómero de histidina está posicionado por fuera del sitio de unión de la alanina, con la cual el interferón madre a su receptor; en cambio, el isómero de lisina está posicionado en el mismo lugar, aparte de que las cargas eléctricas sean distintas y puedan afectar la calidad de interacción con el receptor, así como el tamaño de la molécula de PEG, la que puede bloquear u ocupar parte del sitio donde debe interactuar el receptor.
Sólo se pueden obtener dos conclusiones definitivas: una, que la mayor exposición al fármaco no significa mayor efecto biológico ni mejor eficacia antiviral (esto es lo más conservador); y segundo, que el impacto a largo plazo de estos resultados no se puede definir en este estudio; para hacerlo se necesita un estudio prospectivo, comparado y controlado (Fig. 12).
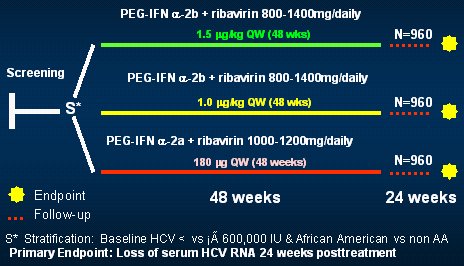 Tamaño completo
Tamaño completo Figura 12. Estudio ideal: HCV 1 Naive.

