Congresos
← vista completaPublicado el 1 de abril de 2008 | http://doi.org/10.5867/medwave.2008.03.900
Estudio TORCH y mortalidad en EPOC: ¿un cambio en el paradigma de tratamiento?
TORCH study and mortality in COPD: a change in treatment paradigm?
Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso de Enfermedades Respiratorias 2007, realizado en Pucón los días 7 al 10 de noviembre de 2007. El evento fue organizado por la Sociedad Chilena de Enfermedades Respiratorias.
Presidente Sociedad Chilena de Enfermedades Respiratorias: Dr. Raúl Corrales.
Introducción
Esta conferencia se ha dividido en dos partes. En la primera se hablará sobre TORCH (TOwards a Revolution in COPD Health), el mayor estudio que se ha hecho sobre EPOC, cuya importancia radica en el hecho de que por primera vez se evaluó el impacto de un tratamiento, no sólo sobre el VEF1, sino también sobre la mortalidad, abriendo las puertas a un nuevo enfoque en el manejo de esta enfermedad. En la segunda parte se hablará sobre biomarcadores, porque la futura farmacoterapia de muchas enfermedades, entre ellas la EPOC, se desarrollará con base en el impacto que las nuevas drogas tengan sobre aquellos fenotipos portadores de biomarcadores previamente determinados.Uno de los aspectos más importantes del estudio TORCH es que incluyó a 6000 pacientes procedentes de 444 centros de un total de 42 países de todo el mundo, incluidas las Américas, Europa, Oceanía, Asia y Africa. La variable principal de valoración en el estudio TORCH fue el efecto de la combinación SFC (salmeterol fluticasona) 50/500 ug versus placebo sobre la mortalidad por todas las causas durante tres años en pacientes con EPOC moderada a grave. Se eligió la mortalidad por todas las causas como el criterio principal de valoración para estar seguros de que el tratamiento no esté reduciendo la mortalidad por una de las causas y aumentando la mortalidad por otras. La mortalidad por todas las causas es un punto final más robusto que la mortalidad por una causa única: la EPOC es una enfermedad y los pacientes mueren por causas distintas de la EPOC, incluyendo cáncer de pulmón y enfermedades cardiovasculares. Además, la mortalidad por todas las causas no depende de la codificación práctica, que puede variar entre los países y puede hacer que sea muy difícil distinguir en forma confiable entre la muerte debida a EPOC y aquélla en que la EPOC es un factor que contribuye. Por último, la elección de mortalidad por todas las causas como la variable principal de valoración otorga mayor poder al estudio, debido al número de eventos probable (1).
Los pacientes a los que se retiró prematuramente del estudio también se siguieron en forma regular durante tres años a partir de la fecha de asignación al azar, a fin de determinar la condición de supervivencia. Los puntos finales secundarios del estudio TORCH fueron: el impacto sobre la morbilidad por EPOC, medida por la tasa de exacerbaciones moderadas y graves; sobre la la calidad de vida (Health-related quality of life = HRQoL), medida por el St George's Respiratory Questionnaire (SGRQ) en intervalos de 24 semanas; y sobre la función pulmonar (2).
Era la primera vez que un estudio iba más allá del VEF1 y planteaba como objetivo principal evaluar el impacto sobre la mortalidad. Sin duda, se requirió valor para arriesgarse a emplear un instrumento que se utilizaba en el asma, para evaluar el impacto en la mortalidad; el crédito es de Glaxo, que invirtió millones de dólares para intentar cambiar el patrón oro y establecer que éste debe ser la sobrevida. Sin embargo, también se plantearon otros objetivos secundarios, como la tasa de exacerbaciones, que se puede considerar como “la angina inestable” o “el infarto de miocardio” del EPOC, además del efecto en la calidad de vida y la función pulmonar, para lo cual se hizo una espirometría cada seis meses a cada uno de los 6.000 pacientes, acumulándose un total de 95.000 espirometrías aceptables.
También por primera vez en un estudio grande, se evaluó la seguridad del tratamiento. Con este objetivo se documentó cada evento adverso o enfermedad concurrente que se produjo durante el estudio, así como las fracturas traumáticas y no traumáticas y su localización anatómica y la densidad ósea, medida por dexascan, en 690 pacientes de los Estados Unidos. Finalmente se hizo un examen orofaríngeo en cada visita clínica para comprobar la presencia de candidiasis oral.
Diseño del estudio TORCH
TORCH fue un estudio de tres años, internacional, multicéntrico, controlado con placebo, doble ciego, aleatorio y de grupos paralelos. El primer paciente se reclutó en 2000 y los resultados estuvieron disponibles en 2006. Se admitieron pacientes con EPOC moderada a grave, que cumplieran con los siguientes criterios de inclusión: edad de 40 a 80 años; historia clínica clara de EPOC; antecedente de tabaquismo por 10 o más años; volumen espiratorio forzado en el primer segundo (VEF1) basal menor de 60% de lo previsto, antes del broncodilatador; reversibilidad menor de 10% del valor predicho de VEF1 y relación VEF1/CVF (capacidad vital forzada) igual o menor de 70%. El diseño del estudio incluyó período de run-in de 2 semanas y una fase de tratamiento de 3 años. Los pacientes se asignaron al azar a uno de los siguientes cuatro grupos de tratamiento, que se administró dos veces al día a través de un inhalador de polvo seco (dispositivo diskus): Placebo, SAL 50 ug (salmeterol, un beta 2 agonista de acción prolongada), FP 500 ug (un corticosteroide inhalado) y SFC 50/500 ug (Fig. 1).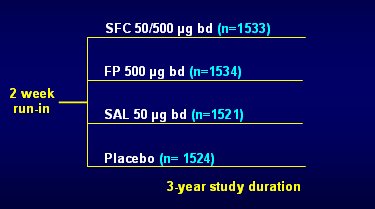 Tamaño completo
Tamaño completo Figura 1. TORCH: diseño del estudio
Se permitió a los pacientes continuar con todas las medicaciones por condiciones distintas de la EPOC durante el estudio y se permitió llevar a cabo tratamientos para dejar de fumar. Los medicamentos para EPOC permitidos fueron las teofilinas de larga y corta acción, los agentes anticolinérgicos de acción corta y los beta 2 agonistas de acción corta. Se proporcionó salbutamol para su uso como medicamento de rescate, durante todo el estudio. Se suspendió el uso de corticosteroides inhalados y broncodilatadores de acción prolongada, incluidos los beta 2 agonistas de acción prolongada y los agentes anticolinérgicos de acción prolongada en la visita 1 (antes del run-in) y se indicó a los sujetos que no iniciaran tratamiento con estos medicamentos, excepto los proporcionados por el estudio, durante el período de tratamiento. Se prohibió el uso de corticosteroides sistémicos a largo plazo, definido como uso crónico, continuo durante más de 6 semanas). Los sujetos podían tomar cursos cortos de corticosteroides sistémicos si era necesario para el tratamiento de una exacerbación; los cursos cortos de corticosteroides sistémicos separados por un período de menos de 7 días se consideraron como uso continuo. Durante el estudio, incluidos el run-in y el período de seguimiento, se permitieron cambios en la medicación EPOC, por ejemplo, para el tratamiento de las exacerbaciones.
La hipótesis de investigación de Glaxo planteaba que la fluticasona es la molécula que, por su efecto antiinflamatorio, disminuye la inflamación y por lo tanto, la mortalidad; y que la combinación con salmeterol magnifica este efecto. El control fue el placebo, que implica no administrar ninguna de estas dos medicaciones y, a pesar de que la comparación entre ambas no era el objetivo del estudio, se incluyó una rama con fluticasona y una rama con salmeterol, lo que quizás redujo la probabilidad de demostrar el impacto sobre la mortalidad, porque hubo cuatro ramas con 1500 pacientes en cada una, en lugar de dos ramas con 3000 pacientes. Sin embargo, esta base de datos de 1500 personas permitió investigar el efecto del salmeterol solo, lo cual fue positivo, ya que a raíz de los resultados del estudio SMART (The Salmeterol Multicenter Asthma Research Trial) corría el rumor de que el uso de salmeterol estaba asociado a mayor mortalidad.
Resultados del estudio TORCH: mortalidad
La causa de muerte puede ser difícil de determinar, ya que con frecuencia se certifica como causa el “paro cardíaco”; para evitar este problema se creó una comisión llamada Comisión de Desenlaces Clínicos (Clinical Endpoint Committee) independiente, que revisó todos los antecedentes de los 1000 pacientes que fallecieron, en el mundo. Así, se determinó que las causas de muerte de los pacientes con EPOC, en este estudio, fueron: enfermedad respiratoria, 35%; enfermedad cardíaca, 27%; cáncer, 21%; otras, 10% y en 7% de los casos, no se pudo determinar. Por lo tanto, la mayoría de los pacientes con EPOC mueren por problemas respiratorios, aunque las enfermedades cardíacas explican un porcentaje bastante alto (Fig. 2).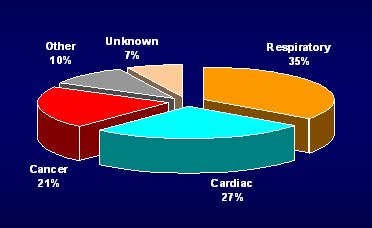 Tamaño completo
Tamaño completo Figura 2. TORCH: Causas de muerte, determinadas según el comité de punto final clínico CEC (Clinical Endpoint Committee)
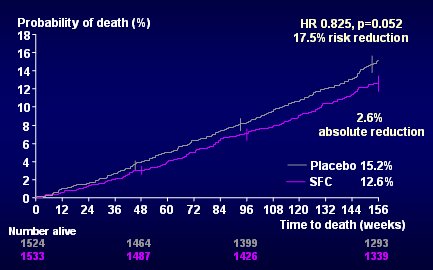
En la Fig. 3 se observa el placebo, en gris y la combinación de salmeterol y fluticasona, en morado: hubo una diferencia de 17% en la disminución del riesgo relativo; la reducción absoluta fue 2,6%. Hay dos formas de interpretar este resultado: se puede decir que el resultado fue negativo, porque el valor de p fue 0,052, aunque, si hubiera sido 0,048, se habría considerado positivo. Sin embargo, si bien este valor es negativo desde el punto de vista estadístico, también está indicando que hubo 5,2 chances en 100 de que el resultado que se observó se deba al azar. Esto puede tener dos explicaciones; en primer lugar, la mortalidad fue menor que lo que se esperaba, se hizo un análisis de probabilidades con base en una mortalidad de 17%, pero la cifra real fue 15%; en segundo lugar, muchos pacientes abandonaron el placebo y es muy probable que al menos la mitad de ellos se hayan tratado posteriormente con esteroides inhalados y salmeterol, pero en el análisis se siguieron considerando por la intención de tratamiento, como si estuvieran en el grupo placebo. Considerando estos elementos, la reducción del riesgo de mortalidad con la combinación cobra mayor importancia (3).
 Tamaño completo
Tamaño completo Figura 3. Mortalidad por todas las causas a tres años. Curva de placebo y SFC (3)
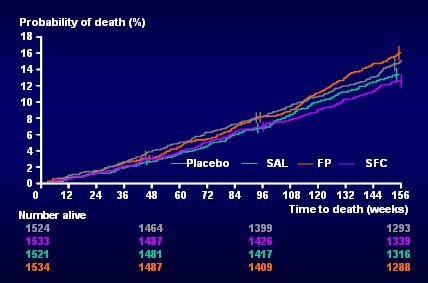
Las otras dos ramas son sumamente interesantes. En la Fig. 4 se muestra en verde el resultado de salmeterol, que fue muy bueno, ligeramente mejor que el placebo. En la rama de salmeterol no hubo muertes fuera de lo común ni daños de ningún tipo, lo que, desde el punto de vista práctico, significa que un beta agonista de acción prolongada como el salmeterol es útil en pacientes con EPOC y además es bastante seguro. En cuanto a la rama de fluticasona, para quienes creen que la inflamación es el factor central en la EPOC el comportamiento del corticoide fue sorprendente, porque la probabilidad de muerte con fluticasona sola, aunque no fue diferente de placebo o de salmeterol, fue mayor que con la combinación, en forma estadísticamente significativa.
Con estos resultados, quien expone (Dr. Celli) plantea que los esteroides inhalados se deberían administrar siempre en combinación con un beta agonista de acción prolongada en la EPOC y que los patrones y guías de clínicas deberían incorporar estos cambios (3).
 Tamaño completo
Tamaño completo Figura 4. Mortalidad por todas las causas a tres años. Curvas de placebo, salmeterol, fluticasona y SFC (3)
Resultados del estudio TORCH: exacerbaciones y calidad de vida
El análisis del número de exacerbaciones que requirieron corticosteroides sistémicos indica que el salmeterol las redujo en 18%; la fluticasona, en 30%; y la combinación, en 40% (Fig. 5).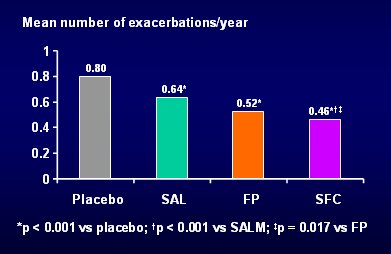 Tamaño completo
Tamaño completo Figura 5. Tasa de exacerbaciones que requirieron corticosteroides sistémicos
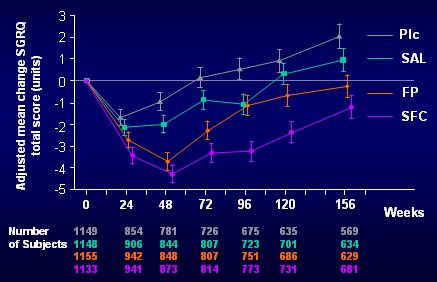
La calidad de vida se midió con el SGRQ (St George's Respiratory Questionnaire). Los resultados se muestran en la Fig. 5: con el placebo todos tuvieron cierta mejoría al principio, pero después decayeron y al finalizar los tres años estaban peor que al comienzo; con el salmeterol el resultado fue un poco mejor; la curva de la fluticasona fue bastante parecida a la del salmeterol; y la combinación tuvo un resultado significativamente mejor, ya que los pacientes estaban mejor que en su estado basal al cumplir los tres años, en contraste con los que recibieron placebo, que estaban significativamente peor después de ese lapso.
 Tamaño completo
Tamaño completo Figura 6. Score SGRQ total
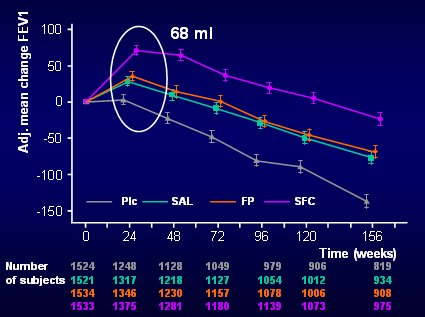
El VEF1 es un verdadero “santo grial” para todo el mundo: todos consideran que los tratamientos deben mejorar el VEF1 y que eso es lo único que importa en EPOC. Pues bien, los hallazgos del estudio TORCH en lo que se refiere al VEF1 fueron muy interesantes. Los pacientes del grupo placebo no mejoraron este parámetro a los seis meses, mientras que todos los demás grupos lo mejoraron, especialmente el grupo que recibió la combinación, en el cual el VEF1 era mayor que el del grupo placebo en 68 ml, como se ve en el gráfico de la Fig. 7.
 Tamaño completo
Tamaño completo Figura 7. VEF1 post broncodilatador (ml). Evaluación a los 6 meses
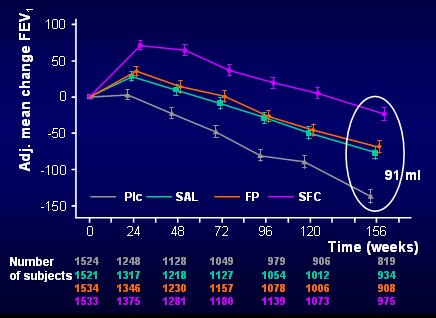
Al finalizar los tres años la diferencia entre la curva de SFC y placebo era de 91 ml, lo que significa que no sólo hubo un efecto broncodilatador, sino que a los tres años de tratamiento la caída del VEF1 fue mucho mayor en el grupo placebo que en los otros tres, a pesar de que 40% de los pacientes del grupo placebo dejaron de participar en el estudio y se sabe que fueron los que estaban peor (Fig. 8).
 Tamaño completo
Tamaño completo Figura 8. VEF1 post broncodilatador: evaluación a los 3 años
En el siguiente gráfico se observan las mismas curvas, pero en el eje de las “Y” está el VEF1, es decir, aquí no se comparó cada paciente con su principio, sino que se registró su volumen absoluto y se hizo un análisis de la pendiente entre los seis meses y los tres años para ver lo que pasó con la pendiente de broncodilatación máxima. La pendiente se identificó con los mismos colores. Se puede ver que hubo una diferencia significativa, de aproximadamente 16 ml, entre la curva de SFC y la de placebo; además hubo una diferencia de 13 ml entre la curva de SFC y las curvas de salmeterol y fluticasona solos. El primer resultado indica que el uso de SFC se asoció a una disminución de 36% en la pendiente de caída del VEF1, en comparación con placebo: es la primera vez que una farmacoterapia logra cambiar esta pendiente.
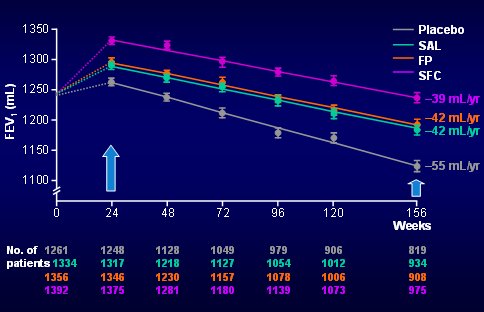 Tamaño completo
Tamaño completo Figura 9. Tasa de declinación de la función pulmonar: efecto del tratamiento
En la Fig. 10 se muestra el mismo gráfico, pero las curvas corresponden a los que presentaron 0, 1 ó 2 o más exacerbaciones en el año previo, según interrogatorio, al ingresar al estudio; se puede ver que el número de exacerbaciones en el año previo no influye sobre la pendiente de la caída del VEF1 (Fig. 10).
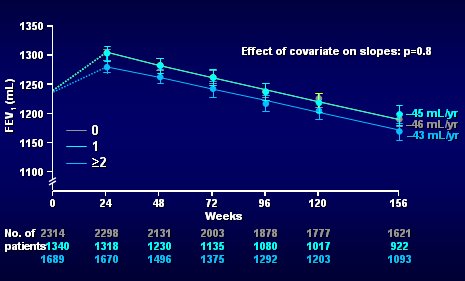 Tamaño completo
Tamaño completo Figura 10. Declinación en el VEF1 según número de exacerbaciones en el año previo
Sí hubo influencia del número de exacerbaciones durante el estudio: a mayor número de exacerbaciones, mayor fue la pérdida de función pulmonar, lo que no es nuevo. Lo novedoso fue la diferencia que se observó en la pérdida de función pulmonar según índice de masa corporal (IMC). Al comparar los individuos delgados, con IMC 20 a 25, con los individuos con IMC de 25 a 29 y con aquellos con IMC mayor de 29, se encontró que los más delgados tuvieron mayor pérdida de función pulmonar. Por lo tanto, para un individuo con EPOC el tener bajo peso es de muy mal pronóstico y esta característica podría ser un biomarcador (Fig. 11).
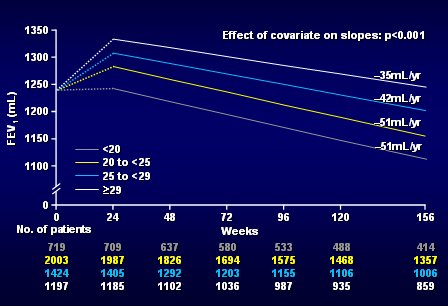 Tamaño completo
Tamaño completo Figura 11. Declinación en el VEF1 según índice de masa corporal
También se comparó la tasa de declinación del VEF1 en distintas regiones del mundo, como Estados Unidos, Asia, Europa Oriental, Europa Occidental, etc. y se encontró que los individuos de países más desarrollados, como Estados Unidos y Europa Occidental, perdieron más función pulmonar que los japoneses y los individuos de Europa Oriental, en forma estadísticamente significativa. La causa de esto no está clara, seguramente existen factores regionales que no se han explorado. Sería interesante ver si en Chile existen diferencias entre los habitantes de las distintas regiones (Fig. 12).
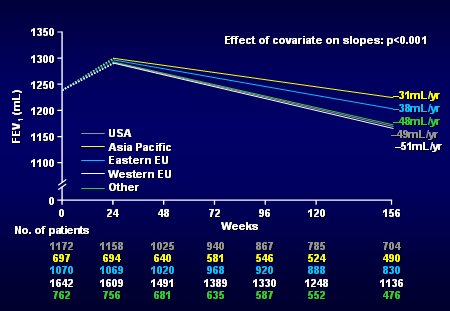 Tamaño completo
Tamaño completo Figura 12. Declinación en el VEF1 según región
Finalmente, al analizar las diferencias por género corrigiendo por la talla, se encontró que la pérdida de función pulmonar fue similar en hombres y mujeres.
Estudio TORCH: efectos colaterales
La prevalencia de osteoporosis en el primer corte, en 700 norteamericanos, hombres y mujeres, con EPOC, fue 50%: la mitad de los pacientes con EPOC examinados tenían osteoporosis clínica y radiológica; sin embargo, la gran mayoría de los médicos no solicita un dexascan ni busca osteoporosis en los pacientes con EPOC. En el estudio TORCH, la osteoporosis se correlacionó con el IMC: los individuos con IMC bajo, además de tener poca grasa y músculo, tenían huesos osteoporóticos. Por otra parte, los distintos tratamientos, salmeterol, placebo, fluticasona, no tuvieron ningún impacto en este aspecto: no aumentaron ni redujeron el nivel de ospteoporosis natural asociado con la enfermedad.Sí se encontró mayor tasa de neumonía. En la Tabla I se muestra el número de pacientes en las 4 ramas: placebo, salmeterol, fluticasona y combinación; se observa que un número relativamente pequeño, pero significativamente mayor de pacientes tuvieron neumonía en las dos ramas que recibieron esteroides, en comparación con placebo y salmeterol, aún cuando ello no se expresó en mayor mortalidad. En este momento hay estudios dirigidos a identificar a aquellos pacientes que tienen mayor riesgo de desarrollar neumonía en el curso de estos tratamientos.
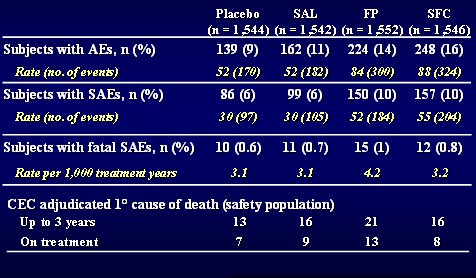 Tamaño completo
Tamaño completo Tabla I. Reporte de neumonía (AE: adverse event; SAE = serious AE; CEC = Clinical Endpoint Committee)
En la Fig. 14 se resumen los resultados del estudio TORCH: en VEF1, 92 ml de diferencia con placebo después de tres años, sin mencionar si ese cambio es o no significativo; 25% de reducción de exacerbaciones y hospitalizaciones y St George´s 3,1 unidades mejor que el placebo, al final de tres años. Esto, sumado a la baja carga de efectos colaterales, indica que la terapia que combina salmeterol y fluticasona es beneficiosa en pacientes con EPOC. Los datos disponibles sugieren que en los pacientes con EPOC cuyo VEF1 sea menor de 60%, se debería indicar esta medicación.
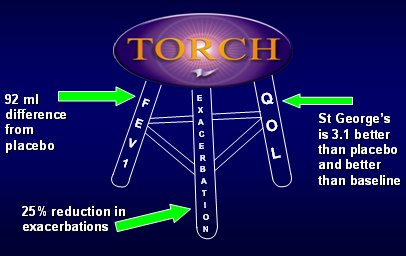 Tamaño completo
Tamaño completo Figura 13. Resumen de resultados globales del estudio TORCH
Medwave. Año VIII, No. 3, Abril 2008. Derechos Reservados.
La edición y publicación de esta conferencia han sido posibles gracias al auspicio de GlaxoSmithKline
- Vestbo J, TORCH Study Group. The TORCH (TOwards a Revolution in COPD Health) survival study protocol. Eur Respir J 2004; 24:206–10).
- Sin DD, Anthonisen NR, Soriano JB, Agusti AG. Mortality in COPD: role of comorbidities. Eur Respir J 2006; accepted.
- Calverley et al NEJM 2007; 356:775.
Referencias
- La riqueza de un estudio como TORCH es que ha permitido estudiar, en un gran número de personas, qué es la EPOC y qué factores influyen en esta enfermedad; a partir de esto se podrá pensar en qué forma se puede modificar.
- TORCH es el primer estudio que demuestra un posible beneficio de la farmacoterapia sobre la mortalidad en EPOC; esto ha abierto las puertas para otros estudios similares, como UPLIFT (Understanding Potential Long-term Impacts on Function with Tiotropium), actualmente en curso.
- La combinación (SFC) disminuye las exacerbaciones y mejora la calidad de vida.
- La farmacoterapia mejora la función pulmonar y cambia la tasa de caída del VEF y esto por primera vez se demuestra en un estudio farmacológico.
- Hay efectos colaterales conocidos, que se deben monitorizar: la osteoporosis es un problema en EPOC y hay un aumento de las neumonías, que se debe estudiar mejor.
- Se espera que en el año 2008 se entreguen los primeros resultados de UPLIFT, que va a determinar, en 6000 pacientes seguidos por 4 años, el efecto de tiotropium sobre el VEF1 meseta la mañana después del tratamiento, además de ver lo que pasa en términos de mortalidad, calidad de vida y disnea.
- A raíz de los resultados del TORCH se ha abierto la posibilidad de buscar marcadores específicos en los pacientes con EPOC, que se puedan considerar como una señal, de modo de determinar en qué pacientes está presente esa señal e idear una terapia que actúe sobre ella y la modifique. A esto deberá apuntar la moderna búsqueda de los biomarcadores.
Conclusiones

