Resúmenes Epistemonikos
← vista completaPublicado el 6 de mayo de 2019 | http://doi.org/10.5867/medwave.2019.04.7625
PET-CT para el manejo de pacientes con cáncer testicular tipo seminoma con masa residual post quimioterapia
PET-CT for the management of testicular seminoma patients with post-chemotherapy residual masses
Resumen
INTRODUCCIÓN En pacientes con cáncer testicular avanzado tipo seminoma que tienen lesiones residuales post quimioterapia de más de 3 cm, el PET-CT podría seleccionar un subgrupo susceptible de ser manejado con seguimiento, evitando una resección quirúrgica innecesaria de tumor no viable.
MÉTODOS Realizamos una búsqueda en Epistemonikos, la mayor base de datos de revisiones sistemáticas en salud, la cual es mantenida mediante el cribado de múltiples fuentes de información, incluyendo MEDLINE, EMBASE, Cochrane, entre otras. Extrajimos los datos desde las revisiones identificadas, analizamos los datos de los estudios primarios, realizamos un metanálisis y preparamos una tabla de resumen de los resultados utilizando el método GRADE.
RESULTADOS Y CONCLUSIONES Identificamos tres revisiones sistemáticas que en conjunto incluyeron 11 estudios primarios, de los cuales, ninguno es un ensayo aleatorizado. Concluimos que el uso de PET-CT en la evaluación de masas residuales post quimioterapia en pacientes con cáncer testicular tipo seminoma podría evitar un porcentaje importante de cirugías innecesarias (certeza de la evidencia baja). Además, el uso de PET-CT podría presentar balances riesgo/beneficio y costo/beneficio favorables en el manejo de pacientes con cáncer testicular tipo seminoma. Sin embargo, se requieren revisiones sistemáticas y estudios primarios que evalúen directamente el impacto diagnóstico del test.
Problema
El cáncer de testículo es la neoplasia más común en hombres entre 15 y 44 años. Se divide para su manejo en dos tipos: seminoma y no seminoma. Aproximadamente 30% de los casos debutan con enfermedad metastásica o bien evolucionan con recurrencia sistémica. En esos casos la intención de la terapia sigue siendo curativa; se indica quimioterapia basada en platino, y resección de masas residuales post tratamiento. Dado que los resultados en cuanto a sobrevida son muy buenos (hasta 90% de curación en pacientes de bajo riesgo), el foco actual está en minimizar toxicidades del tratamiento [1].
En el cáncer testicular tipo seminoma el tratamiento induce una reacción desmoplásica del tejido tumoral que hace técnicamente más compleja y de mayor morbilidad su resección; adicionalmente, muchas veces estas lesiones no tienen tumor viable, independiente de su tamaño. Considerando estos factores se acepta que, en esta histología, es seguro el seguimiento, sin cirugía, de lesiones residuales post quimioterapia de hasta 3 cm [2].
Durante los últimos años se ha popularizado el uso de la tomografía por emisión de positrones- tomografía computarizada (PET-CT) para seleccionar pacientes con seminoma que se podrían beneficiar de seguimiento de sus masas residuales post tratamiento, evitando su resección quirúrgica aunque midan más de 3 cm.
Métodos
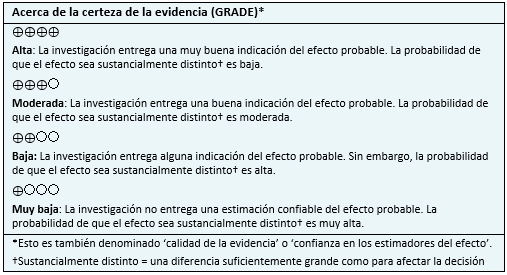
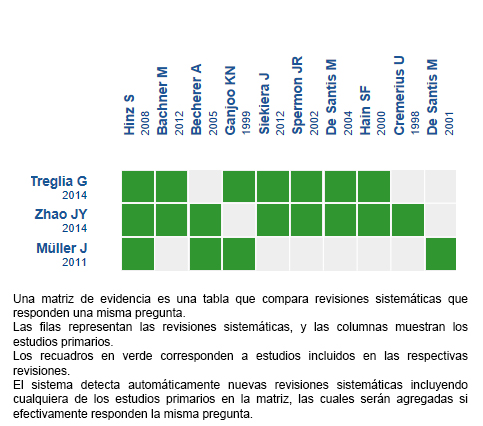
Realizamos una búsqueda en Epistemonikos, la mayor base de datos de revisiones sistemáticas en salud, la cual es mantenida mediante búsquedas en múltiples fuentes de información, incluyendo MEDLINE, EMBASE, Cochrane, entre otras. Extrajimos los datos desde las revisiones identificadas y analizamos los datos de los estudios primarios. Con esta información, generamos un resumen estructurado denominado FRISBEE (Friendly Summaries of Body of Evidence using Epistemonikos), siguiendo un formato preestablecido, que incluye mensajes clave, un resumen del conjunto de evidencia (presentado como matriz de evidencia en Epistemonikos), metanálisis del total de los estudios cuando sea posible, una tabla de resumen de resultados con el método GRADE y una sección de otras consideraciones para la toma de decisión.
|
Mensajes clave
|
Acerca del conjunto de evidencia para esta pregunta
|
Cuál es la evidencia |
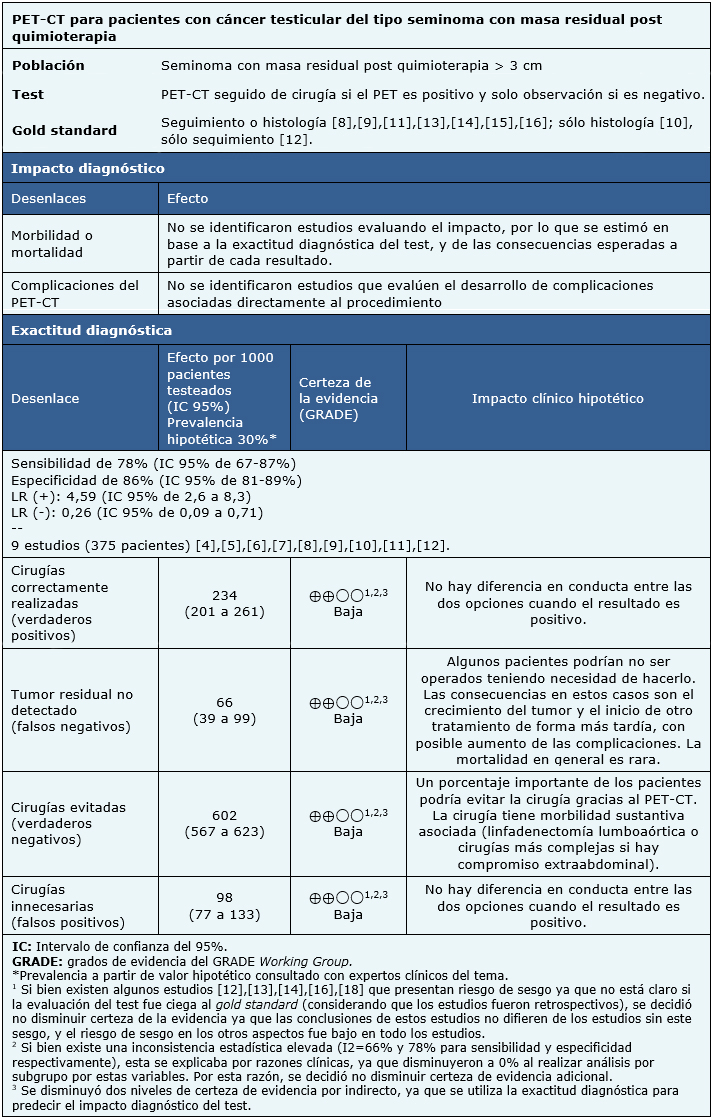
Encontramos tres revisiones sistemáticas [3], [4], [5] que incluyeron 11 estudios primarios en 13 referencias [6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16], [17], [18] de los cuales ninguno corresponde a evaluación de impacto diagnóstico y todos corresponden a exactitud diagnóstica. Este resumen considera sólo a pacientes con cáncer testicular tipo seminoma. Por lo cual, al analizar las revisiones, se descartó la utilización de una de ellas por no entregar un análisis por separado de seminoma y no seminoma [4] y de otra por su baja cobertura y limitaciones metodológicas [5]. Además, fueron excluidos dos estudios en esta revisión [6], [7] por no presentar datos susceptibles de ser incorporados a un metaanálisis. Así, esta tabla y el resumen en general se basan en nueve estudios primarios [8], [9], [10], [11], [12], [13], [14], [15], [16], utilizando los resultados de exactitud diagnóstica entregados por una de las revisiones [3]. |
|
Qué tipo de pacientes incluyeron los estudios* |
La edad promedio reportada en cada estudio estuvo entre 29 a 42,5 años. Seis estudios incluyeron pacientes con seminoma puro [9], [10], [11], [12], [13], [15], mientras que tres estudios incluyeron pacientes con tumores tipo seminoma y no seminoma [8], [14], [16]. No se pudo obtener el perfil de marcadores tumorales desde la revisión sistemática incluida [3]. Un estudio incluyó pacientes post quimioterapia de primera línea [8], el resto incluyó pacientes post quimioterapia de primera línea y/o rescate [9], [10], [11], [12], [13], [14], [15], [16]. Un estudio también incluyó pacientes post radioterapia [13]. |
|
Qué tipo de intervenciones incluyeron los estudios* |
En todos los estudios se utilizó PET con 18F-fluorodesoxiglucosa (18F-FDG) [8], [9], [10], [11], [12], [13], [14], [15], [16]. En cuatro estudios se realizó FDG/PET-CT [6], [13], [14], [17]. El momento de realización varió entre las 4 y 12 semanas post quimioterapia. La dosis de 18F-FDG y el tiempo entre inyección y registro de imagen cumplió los protocolos locales de cada centro. Todos los estudios compararon contra tomografía computada [8], [9], [10], [11], [12], [13], [14], [15], [16]. Los gold standard utilizados fueron: solo seguimiento en un estudio [12], histología obtenida por cirugía en otro [10] y seguimiento o histología en los 7 estudios restantes [8], [9], [11], [13], [14], [15], [16]. |
|
Qué tipo de desenlaces midieron |
Debido a la ausencia de estudios de impacto diagnóstico, se reportaron las propiedades diagnósticas del test, es decir, sensibilidad, especificidad, valor predictivo positivo y negativo, y likelihood ratio positivo (LR+) y negativo (LR-) para identificar presencia de tumor viable en masas residuales post quimioterapia. El rango de seguimiento reportado por los estudios fluctúa entre 12 y 34 meses. |
* La información sobre los estudios primarios es extraída desde las revisiones sistemáticas identificadas, no directamente desde los estudios, a menos que se especifique lo contrario.