Notas metodológicas
← vista completaPublicado el 28 de octubre de 2022 | http://doi.org/10.5867/medwave.2022.09.2622
Revisiones sistemáticas: conceptos clave para profesionales de la salud
Systematic reviews: Key concepts for health professionals
Resumen
El crecimiento exponencial de evidencia disponible actualmente ha hecho necesario recopilar, filtrar, valorar críticamente y sintetizar la información biomédica para mantenerse actualizado. En este sentido, las revisiones sistemáticas constituyen una herramienta útil y pueden ser fuentes confiables para asistir a la toma de decisiones basadas en evidencia. Definimos como revisiones sistemáticas a aquellas investigaciones secundarias o síntesis de evidencia focalizadas en una pregunta específica que, a partir de una metodología estructurada, permiten identificar, seleccionar, valorar críticamente y resumir los hallazgos de estudios relevantes. Las revisiones sistemáticas presentan varias ventajas potenciales, tales como la minimización de sesgos o la obtención de resultados de mayor precisión. La confiabilidad de la evidencia presentada en las revisiones sistemáticas está determinada, entre otros factores, por su calidad metodológica, pero también por la calidad de los estudios incluidos. Para realizar una revisión sistemática, se debe seguir una serie de pasos que incluyen la formulación de una pregunta de investigación a partir del formato PICO; una búsqueda bibliográfica exhaustiva; la selección de los estudios relevantes; la valoración crítica de los datos obtenidos a partir de los estudios incluidos; la síntesis de resultados, a menudo mediante métodos estadísticos (metanálisis); y finalmente una estimación de la certeza de evidencia para cada desenlace. En esta nota metodológica definiremos los conceptos básicos sobre revisiones sistemáticas, sus métodos y sus limitaciones.
Ideas clave
- Las revisiones sistemáticas son una forma de síntesis de evidencia que pueden ser fuentes confiables para asistir la toma de decisiones basadas en evidencia.
- Entre las ventajas de las revisiones sistemáticas, se encuentra la minimización de los sesgos y el aumento de la precisión de los resultados.
- Se guían por una pregunta específica y una metodología estructurada que permiten identificar, seleccionar, valorar críticamente y sintetizar cualitativamente o cuantitativamente (metanálisis) los hallazgos de estudios individuales.
- Algunas limitaciones pueden incluir: la pobre calidad de su elaboración, su desactualización periódica, la calidad de los estudios incluidos (garbage-in/garbage-out), la redundancia y duplicidad, la inclusión de estudios problemáticos (potencialmente fraudulentos) y los conflictos de intereses.
Introducción
En las últimas décadas la cantidad de evidencia científica en salud ha crecido sorprendentemente, estimándose que cada día se publican 75 ensayos clínicos y 11 revisiones sistemáticas [1]. Esto se acentuó durante la pandemia de COVID-19, donde la cantidad de evidencia respecto al tema ha crecido de forma exponencial, con un ritmo de 1000 publicaciones semanales en PubMed [2].
Esta abrumadora cantidad de evidencia imposibilita mantenerse actualizado sin una adecuada síntesis de la información biomédica. Este problema ya había sido identificado décadas atrás por Archie Cochrane, quien en 1979 planteaba el desafío de “tener organizado un resumen crítico actualizado periódicamente por especialidad o subespecialidad de todos los estudios controlados aleatorizados relevantes” [3]. Por lo tanto, se hizo necesario el desarrollo de métodos para recopilar, filtrar y sintetizar información, dentro de los cuales las revisiones sistemáticas, cuando son de alta calidad, son una de las fuentes más confiables y más utilizadas para asistir a la toma de decisiones basada en la evidencia. Es importante aclarar que la toma de decisiones informada en la evidencia no solo toma en cuenta la certeza de la evidencia disponible, sino también considera el balance entre beneficios y daños determinado por los valores y preferencias de los pacientes, y otros aspectos como aceptabilidad, factibilidad y costos [4].
Este artículo corresponde al undécimo de una serie metodológica de revisiones narrativas acerca de tópicos generales en bioestadística y epidemiología clínica, las que exploran y resumen en un lenguaje amigable, artículos publicados disponibles en las principales bases de datos y textos de consulta especializados. La serie está orientada a la formación de estudiantes de pre y posgrado. Es realizada por la Cátedra de Medicina Basada en Evidencia de la Escuela de Medicina de la Universidad de Valparaíso, Chile, en colaboración con el Departamento de Investigación del Instituto Universitario del Hospital Italiano de Buenos Aires, Argentina, el Instituto de Medicina General de la Universidad Heinrich Heine de Düsseldorf, Alemania y el Centro Evidencia UC, de la Pontificia Universidad Católica, Chile.
El propósito de este artículo es explorar y presentar los tópicos más relevantes sobre revisiones sistemáticas y los pasos para la realización de este tipo de estudio. Pretende ser una ayuda en español para estudiantes y profesionales de la salud sin experiencia en revisiones sistemáticas. Nuestros objetivos son definir qué es una revisión sistemática, mencionar sus principales diferencias con otros tipos de síntesis, describir sus pasos y entender cómo estos pueden afectar la confiabilidad de sus hallazgos.
¿Qué es una revisión sistemática?
El Instituto de Medicina de los Estados Unidos define a las revisiones sistemáticas como “una investigación científica que se centra en una pregunta específica y utiliza métodos científicos explícitos y pre especificados para identificar, seleccionar, evaluar y resumir los hallazgos de estudios similares pero separados” [5].
Las revisiones sistemáticas siguen metodologías estructuradas para reducir al mínimo el riesgo de sesgo en el proceso de selección y análisis de la evidencia, lo cual es una diferencia importante con las revisiones narrativas [6]. En primer lugar, cuentan con un protocolo establecido a priori y registrado prospectivamente en bases de datos especializadas como International Prospective Register of Systematic Reviews, PROSPERO [7,8,9]. En un protocolo se explicitan en detalle el marco teórico, los criterios de elegibilidad y desenlaces (outcomes) de interés, la búsqueda y selección de artículos, y los métodos para la valoración del riesgo de sesgo, síntesis y valoración de la certeza de la evidencia [10,11].
¿Cuáles son las principales ventajas de usar una revisión sistemática como fuente de información?
Reduce el sesgo de selección de la evidencia o cherry picking
Al realizar una búsqueda sistemática y exhaustiva de literatura publicada y no publicada, se selecciona toda la evidencia relevante independientemente de sus resultados, evitando la selección sesgada de estudios. Por ejemplo, estudios favorables para una intervención [12].
Puede lograr resultados de mayor precisión
Cuando se realiza una síntesis cuantitativa se utiliza la herramienta de metanálisis, donde se combinan los resultados de los diferentes estudios individuales, disminuyendo el error aleatorio y aumentando la potencia estadística [13]. Sin embargo, esta ganancia en precisión no garantiza la validez de los resultados, dado que se deben considerar otros factores mencionados en el siguiente punto (certeza).
Permite considerar la certeza de los resultados
Considerando el riesgo de sesgo, la imprecisión, la inconsistencia, la evidencia indirecta y sesgo de publicación, mediante la metodología Grading of Recommendations Assessment, Development and Evaluation (GRADE) se puede estimar cuánta confiabilidad podemos asignar a los resultados obtenidos [4,14].
Es importante señalar que existen otras formas de síntesis sistemática de evidencia, que se abordan con más detalle en otras notas metodológicas de Medwave [6]. Entre ellas se encuentran las revisiones panorámicas y mapeos de evidencia [15], las revisiones rápidas [16], las revisiones vivas (de actualización continua) [17], los metanálisis en red [18] y las revisiones de revisiones sistemáticas (u overviews).
Cochrane fue una de las primeras organizaciones en producir y desarrollar revisiones sistemáticas, con el fin de brindar evidencia resumida y confiable que permita aproximarse a una respuesta para las preguntas que surgen constantemente a la hora de toma de decisiones en el ámbito de la salud. Hoy en día, The Cochrane Library cuenta con la Base de Datos Cochrane de Revisiones Sistemáticas (Cochrane Database of Systematic Reviews), una base de datos con más de 8800 revisiones, las cuales cumplen con una rigurosa metodología que se fue ajustando con el paso del tiempo para asegurar el cumplimiento de los criterios de calidad actualizados (descritos en el Manual Cochrane y los estándares Methodological Expectations of Cochrane Intervention Reviews, MECIR) [13,19]. Las revisiones Cochrane se actualizan periódicamente a la par de la emergencia de nueva evidencia. Las revisiones Cochrane contienen Tablas de Resumen de Hallazgos (SoF por su nombre en inglés Summary of Findings) que siguen la metodología GRADE de fácil lectura y comprensión [14].
Otras organizaciones como la Colaboración Campbell (www.campbellcollaboration.org/), el Instituto Joanna Briggs (jbi.global/) y la Colaboración BEME (www.bemecollaboration.org/), entre otras, publican revisiones sistemáticas, algunas con una temática especializada (por ejemplo, educación en el caso de BEME). Además del Manual Cochrane, otras guías metodológicas para revisiones sistemáticas incluyen el manual del Centre for Reviews and Dissemination, el manual del Joanna Briggs Institute, y las guías de la Agencia de Calidad e Investigación en Salud (AHRQ) y el Instituto de Medicina de Estados Unidos (IOM) [5,20,21,22].
Pasos para la realización de una revisión sistemática
1. Formulación de la pregunta, criterios de elegibilidad y desenlaces de interés
El primer paso es definir los elementos clave de la pregunta de investigación, para lo cual se suele utilizar la estructuración de la pregunta en formato participants, interventions, comparisons, outcomes PICO/PECO (población, intervención/exposición, comparación y outcome o desenlace) [23,24] (Tabla 1). Este formato puede variar según si la pregunta es terapéutica, pronóstica, etiológica, diagnóstica u otra (Tabla 2). Una variante de la pregunta PICO podría ser “PICOS” o “PICOTS”, donde la T indica el tiempo de seguimiento y la “S’’ indicaría el tipo de estudio (study design) o contexto del estudio (setting). A fines didácticos, tomaremos como ejemplo una pregunta terapéutica para el desarrollo de este artículo.
Luego de estructurar los elementos básicos de la pregunta PICO, deben establecerse detalladamente los criterios de elegibilidad y desenlaces de interés. Los criterios de elegibilidad se basan principalmente en los elementos de la pregunta PICO. Siguiendo lo anterior, para la pregunta PICO: ‘’en mujeres con riesgo de parto prematuro ¿La administración de corticosteroides prenatales disminuye la morbimortalidad fetal, neonatal y materna?’’ los criterios de elegibilidad deberían considerar las siguientes preguntas:
-
Paciente: mujeres con riesgo de parto prematuro. ¿Qué rango etario se incluirá? ¿Cómo se define el riesgo de parto prematuro? ¿Qué definición de parto prematuro consideraremos?
-
Intervención: corticosteroides prenatales. ¿Se incluyen todas las drogas de esta clase? ¿En qué posología? ¿Por qué vía de administración?
-
Tipo de estudio: ¿Qué diseño de estudios se incluirán? Típicamente en las preguntas terapéuticas se incluyen ensayos clínicos aleatorizados, pero también podrían considerarse estudios observacionales. En preguntas diagnósticas o pronósticas estos últimos son más importantes.
Finalmente, es importante definir los desenlaces (outcomes) de interés. Por ejemplo, para la pregunta PICO anterior, podrían incluirse: mortalidad perinatal, mortalidad materna, riesgo de parto operatorio, dolor en el parto, entre otros.
Los desenlaces pueden clasificarse según su relevancia en "críticos", "importantes" o "no importantes" [29]. Los outcomes clínicamente críticos o importantes son aquellos que de modificarse, cambiarían la aceptación de la intervención por parte de los pacientes. Por ejemplo, un desenlace crítico sería la mortalidad perinatal, y un desenlace poco importante, el dolor en el sitio de inyección de los corticoides. Las revisiones pueden definir también desenlaces "primarios" y "secundarios", habitualmente restringiendo a los primeros las exploraciones analíticas más avanzadas (análisis de subgrupo y de sensibilidad).
A su vez los desenlaces se pueden también clasificar por medir "directa" o "indirectamente" el fenómeno en estudio. Se entiende como desenlaces "subrogados", sustitutos o intermedios a aquellos que no miden directamente el fenómeno en estudio y que, por tanto, sustituyen a un desenlace clínicamente relevante [29]. Por ejemplo, la saturación de oxígeno neonatal es un desenlace subrogado o intermedio al desenlace clínico de estrés respiratorio y mortalidad perinatal.
La iniciativa Core Outcome Measures in Effectiveness Trials (COMET) generó colecciones estandarizadas de desenlaces, denominadas Core Outcome Sets, los cuales corresponden a los mínimos desenlaces que deben medirse e informarse en todos los ensayos clínicos de una condición específica [30]. De la misma manera que estos desenlaces se consideran críticos y relevantes para la toma de decisiones en ensayos clínicos, las revisiones sistemáticas deberían usar los mismos desenlaces para la síntesis de la evidencia de dichos ensayos [31].
2. Búsqueda bibliográfica y selección de estudios
Una vez formulada y estructurada la pregunta PICO y los criterios de elegibilidad, el siguiente paso consiste en establecer las bases de datos en las cuales se realizará la búsqueda bibliográfica. Este es un momento clave, debido a que una búsqueda inadecuada puede llevar a un efecto dominó en el cual las conclusiones obtenidas en una revisión sean imprecisas y poco confiables. Es importante definir:
-
Las fuentes de información: las revisiones sistemáticas suelen usar fuentes diversas y complementarias para la búsqueda incluyendo bases de datos biomédicas como CENTRAL, MEDLINE/PubMed, EMBASE, CINAHL, PsycINFO, Scopus, Web Of Science, entre otras [32]. Cada una de ellas cuenta con especificaciones avanzadas que son detallados en otra nota metodológica de esta serie [33]. Además, las revisiones sistemáticas generalmente incluyen estrategias de búsqueda de literatura gris mediante bases de datos específicas, búsqueda de referencias, consulta con expertos, entre otros [34].
-
Los términos y la estructura de la estrategia de búsqueda: cuando estructuramos una pregunta, debemos identificar los conceptos principales para diseñar una estrategia de búsqueda que incluya los términos pertinentes con nuestra búsqueda y, a su vez, excluyendo aquellos que puedan dificultar la misma. Es aquí donde será necesario utilizar distintas herramientas disponibles dentro de cada plataforma de búsqueda para cada base de datos, dentro de los cuales podemos mencionar a los operadores booleanos (OR, AND y NOT) y los filtros disponibles dentro de cada plataforma (filtrar por año, tipo de estudio, idioma y otros) [32].
El detalle de cómo realizar una búsqueda bibliográfica exhaustiva y estructurada se entrega en otro artículo de esta serie metodológica [33].
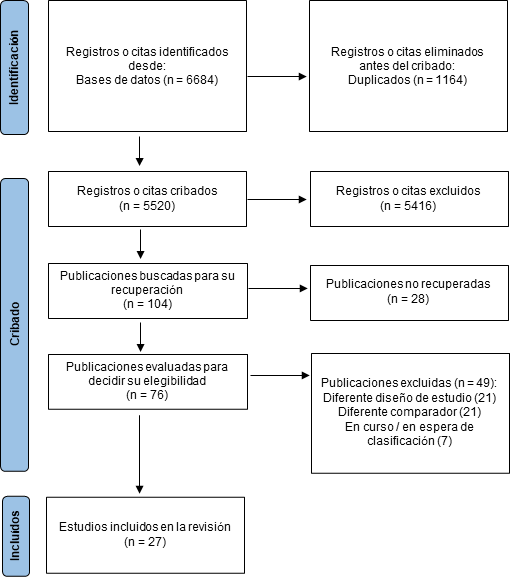
Una vez realizada la búsqueda, se pueden utilizar distintos softwares como Endnote, Covidence, Rayyan y EPPI-Reviewer para la gestión bibliográfica, deduplicación y distintas etapas del proceso de selección, en el cual los autores deben contrastar cada artículo encontrado con los criterios de elegibilidad pre especificados. El proceso suele realizarse en dos etapas consecutivas. La primera, mediante la evaluación del título y resumen, y posteriormente con el texto completo de cada artículo. Una vez seleccionados los estudios incluidos, se procede a la extracción de las características de los estudios y los resultados de interés. Usualmente todo este proceso lo realizan dos o más autores, de forma independiente y cegada al trabajo del otro revisor, para poder contrastar y reducir el riesgo de errores durante el proceso. Las guías Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) proveen una metodología detallada de cómo reportar este proceso, incluyendo un tipo de ‘’diagrama de flujo’’, que posibilita expresar gráficamente la selección de artículos (ejemplo en Figura 1) [35].
Ejemplo de diagrama de flujo tipo PRISMA.
3. Valoración crítica y síntesis de resultados
¿Por qué es importante valorar críticamente los estudios incluidos?
La certeza de los hallazgos presentados en una revisión sistemática va a depender de los sesgos presentes en los estudios que esta incluye. Se entiende como sesgo a un error sistemático o desviación de los resultados respecto a la verdad, que no está determinado por el azar [36]. Si bien muchas veces se homologa un bajo riesgo de sesgo con una alta calidad del estudio evaluado, el concepto de calidad es más amplio, siendo los sesgos una dimensión de esta. La valoración estandarizada de los sesgos presentes en los estudios permite tener una noción de la confiabilidad de los resultados, conceptualizada, junto a otras evaluaciones, en la certeza de evidencia utilizando la metodología GRADE [14]. A su vez, para una correcta evaluación de los posibles sesgos se requiere de un reporte adecuado por parte de los autores de los estudios primarios, siguiendo pautas estandarizadas de reporte. Por ejemplo, los ensayos clínicos deben seguir la guía Consolidated Standards of Reporting Trials, CONSORT, que provee una lista básica de elementos a reportar [37]. Sin embargo, debemos destacar que CONSORT no constituye una guía para evaluar calidad metodológica o sesgos de ensayos clínicos, sino más bien su calidad de reporte.
¿Cómo se valora la presencia de sesgos en los estudios incluidos en las revisiones sistemáticas?
Escalas o listas de verificación
Uno de los métodos más ampliamente utilizados es el uso de escalas o listas de verificación (Checklists). Las escalas otorgan una puntuación a varios componentes de calidad y luego se combinan para obtener una puntuación final, mientras que las listas de verificación constan de ítems o preguntas, las cuales se van llenando a medida que se completa dicha lista. La limitación de estos métodos es que asignan un puntaje o valor equivalente a distintos aspectos relacionados con la calidad metodológica de un estudio y esto puede eventualmente no ser correcto. Por ejemplo, tomando dos aspectos metodológicos de un ensayo clínico, un problema en la aleatorización puede ser una falla importante en comparación a la falta de cegamiento de un estudio que evalúa desenlaces objetivos. Una de las escalas más utilizadas para ensayos clínicos, la escala de Jadad, tiene dichas limitaciones [38].
Evaluación basada en dominios
Constan de evaluaciones críticas realizadas de forma separada para diferentes dominios relacionados con aspectos metodológicos independientes. Siguiendo el ejemplo anterior para ensayos clínicos, los problemas metodológicos relacionados con la aleatorización se evalúan e interpretan por separado de aquellos relacionados con el cegamiento. Sobre la base de esto, se puede pensar de manera independiente cómo estos potenciales sesgos pueden afectar los resultados. La Tabla 3 describe en forma resumida la herramienta Cochrane RoB 2 para ensayos clínicos. Para estudios observacionales existen diversas herramientas, una de las más usadas es la Escala de Newcastle-Ottawa. Sin embargo, recientemente ha sido reemplazada por ROBINS-I [39]. También existen diversas herramientas para estudios diagnósticos y paquetes de evaluación de estudios como los del Joanna Briggs Institute y el Instituto Salud de los Estados Unidos (NIH) [40,41,42,43].
4. Síntesis de resultados
Una vez que se extraen los resultados de cada estudio y se realiza una valoración crítica de los potenciales sesgos, los datos relacionados con los desenlaces se pueden comparar y sintetizar a partir de análisis estadísticos. El método más utilizado es el metanálisis, que permite combinar los resultados de dos o más estudios individuales. El objetivo fundamental de un metanálisis es aumentar la potencia y precisión de los resultados, generando un estimador puntual donde los resultados de los estudios individuales incluidos se encuentren ponderados. En algunos casos permite, además, responder a preguntas no planteadas en estudios individuales (por ejemplo, mediante análisis por subgrupos) y explorar las inconsistencias (heterogeneidad) de los hallazgos. Existen diversos programas estadísticos para llevarlos a cabo (por ejemplo, RevMan, Stata y R).
Si bien todo metanálisis debiese ser realizado en contexto de una revisión sistemática, no toda revisión sistemática tiene un metanálisis, dado que debe haber condiciones mínimas de comparabilidad entre las poblaciones, intervenciones, comparaciones y desenlaces de los estudios incluidos para poder realizar la combinación estadística de los mismos. Además, si en la revisión sistemática no se encuentran estudios sobre la pregunta PICO o solo se encuentra uno, no es posible realizar la agregación estadística de dos o más estudios. Otras razones por las que se suele preferir realizar una síntesis narrativa de los hallazgos numéricos de una revisión sistemática incluyen:
-
Preguntas muy amplias que incorporen evidencia dispersa y no comparable.
-
La falta de información estadística de los estudios individuales que impida realizar metanálisis.
-
Diferencias en la población, intervención y comparación que impidan la comparar los resultados de los estudios (heterogeneidad clínica).
-
La presencia de heterogeneidad estadística importante en el metanálisis que potencialmente invalide sus resultados [44].
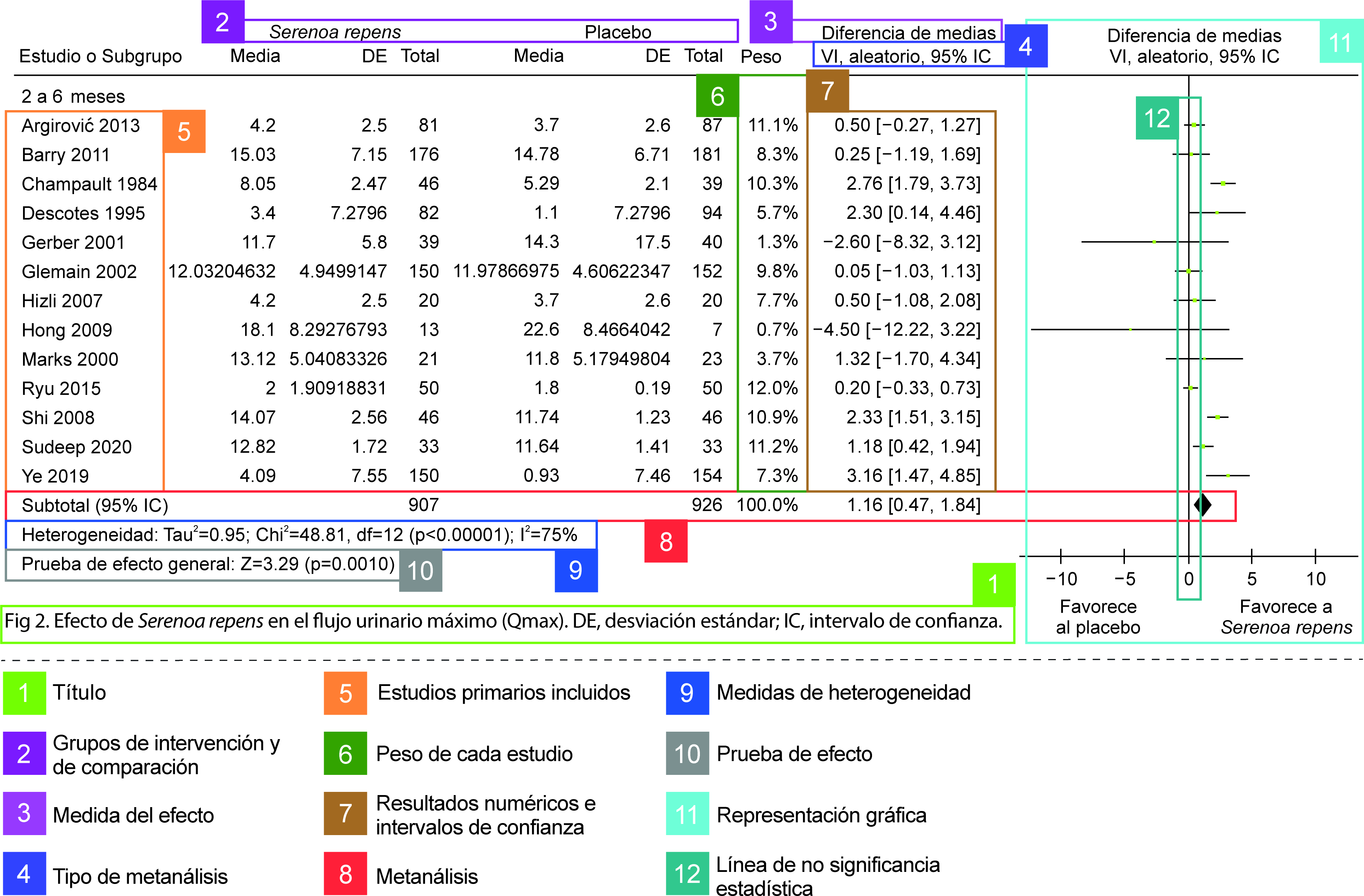
El forest plot corresponde a la representación gráfica de un metanálisis y tiene distintas informaciones, las cuales se detallan en la Figura 2. A la hora de interpretar un forest plot es importante identificar los siguientes elementos clave:
-
Heterogeneidad: qué tan similares son los resultados de estudio a estudio, valorada visualmente o con medidas estadísticas.
-
Metanálisis: la medida sumaria (representada por un “diamante”) que indica el efecto combinado y su intervalo de confianza. Estos intervalos de confianza tienen relevancia a la hora de interpretarlos en relación a los umbrales de significancia clínica.
Ejemplo de
De manera similar a otras pruebas estadísticas, los metanálisis surgen de supuestos que permiten la combinación de los resultados. Fundados en estos supuestos existen dos tipos de metanálisis:
-
El metanálisis de efecto fijo: este modelo asume que existe un único efecto que los distintos estudios incluidos en la síntesis estiman con cierta variabilidad (error aleatorio). Este modelo no considera la variabilidad entre estudios como una fuente de heterogeneidad, por lo cual se usa bajo la suposición de homogeneidad entre los estudios.
-
El metanálisis de efectos aleatorios: este modelo no supone un efecto único, sino múltiples efectos posibles estimados por los estudios incluidos. Además de integrar la variabilidad por error aleatorio, tiene en cuenta la variabilidad entre los estudios y es considerado el modelo más conservador dado que no asume una homogeneidad entre los estudios y, ante la presencia de heterogeneidad, produce resultados menos precisos [46,47].
Estos metanálisis representados en los forest plot se denominan metanálisis directos o pareados (pairwise). Existe un abordaje adicional llamado metanálisis en red (network meta-analysis), cuya metodología permite el uso de evidencia de comparaciones directas e indirectas. El detalle de este tipo de estudio está descrito en detalle en otro artículo de esta serie metodológica [18].
El gráfico de embudo (o funnel plot) es una representación gráfica adicional de las estimaciones del efecto de los estudios individuales en contraste con su precisión, de manera tal que en la base del gráfico se encuentran los estudios menos precisos (usualmente más dispersos alrededor del metanálisis) y en la cúspide los estudios más precisos, habitualmente concentrados alrededor de la estimación del metanálisis (ver Figura 3). Cuando hay una dispersión asimétrica de los estudios pequeños (small study effect) se puede sospechar sesgo de publicación. Sin embargo, existen explicaciones alternativas a este fenómeno y su interpretación debe ser cautelosa.
Ejemplo de gráfico de embudo asimétrico.
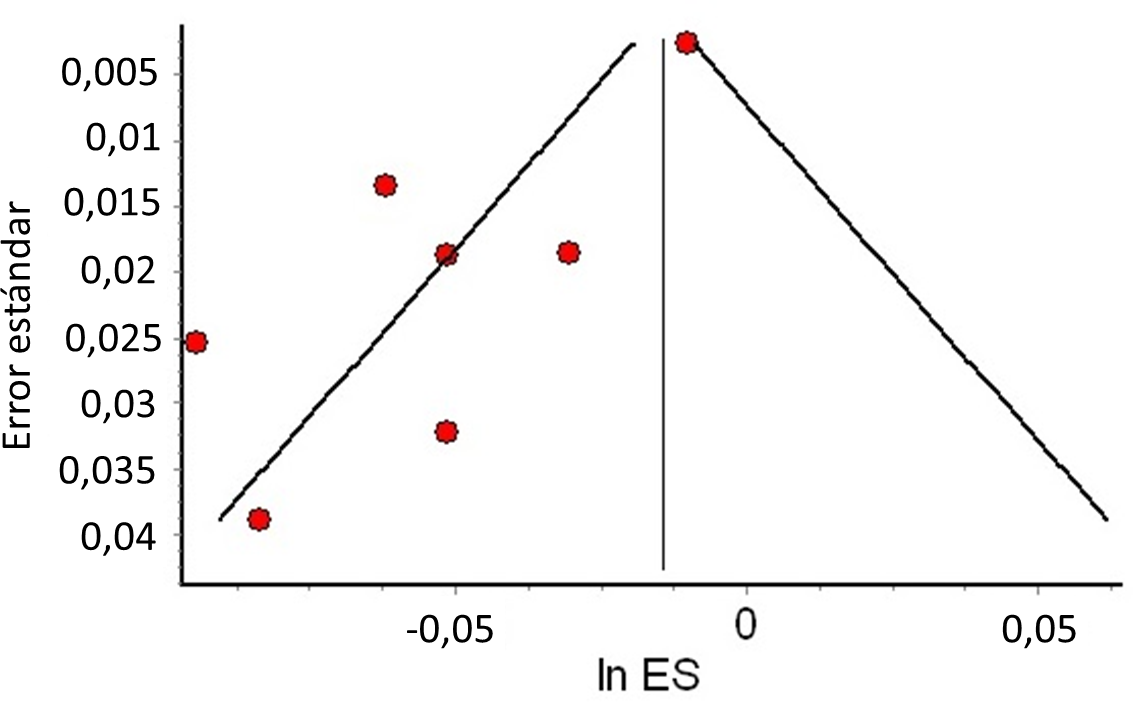
Notas: se puede observar que los puntos rojos de los estudios más pequeños se encuentran asimétricamente distribuidos a la izquierda del metanálisis (línea vertical). En contraste los estudios más precisos se encuentran en la cima del embudo, cerca del metanálisis (punto rojo arriba a la derecha).
5. Formulando las conclusiones en las revisiones sistemáticas
Considerando los múltiples pasos de una revisión sistemática, a la hora de formular las conclusiones deben identificarse las fortalezas y debilidades del cuerpo de la evidencia sintetizado. Debido a la existencia de múltiples sistemas de clasificación de estas fortalezas y debilidades, surgió la metodología GRADE con el objetivo de estandarizar esta valoración. Para ello, GRADE categoriza la certeza de la evidencia en cuatro niveles (alta, moderada, baja y muy baja). Esta certeza está definida por el diseño metodológico de los estudios primarios incluidos, y también por factores que pueden aumentar o disminuir el nivel de certeza, entre los que se encuentran:
-
Riesgo de sesgo.
-
Inconsistencia.
-
Evidencia indirecta.
-
Imprecisión.
-
Sesgo de publicación.
Esta metodología ha sido detallada en otro artículo de esta serie metodológica [14]. Si bien la metodología GRADE es utilizada para determinar la certeza de evidencia y generar recomendaciones, es importante señalar que las revisiones sistemáticas por sí solas no son suficientes para generar una recomendación en salud [4].
Algunas limitaciones y problemas de las revisiones sistemáticas
Pese a sus múltiples ventajas para la toma de decisiones basada en evidencia, las revisiones sistemáticas no están exentas de problemas como cualquier otro estudio científico:
-
Baja calidad metodológica: existen múltiples escalas y listas que nos permiten evaluar la calidad metodológica de las revisiones sistemáticas, la mayoría de estas se enfocan en valorar la transparencia, validez interna y externa, el riesgo de sesgo, entre otros dominios. Cabe la posibilidad que las revisiones sistemáticas vean afectada su calidad de la evidencia debido a múltiples falencias en su estructura y análisis, como por ejemplo, una estrategia de búsqueda limitada, una evaluación insatisfactoria del riesgo de sesgo o exclusión injustificada de estudios primarios. Por ello, se hace necesario y fundamental poder analizar críticamente las revisiones sistemáticas que tenemos disponibles.
-
Redundancia y duplicidad: existen revisiones sistemáticas superpuestas, las cuales no aportan nueva información, debido a que utilizan como fuente un gran porcentaje de estudios primarios previamente utilizados en otras revisiones sistemáticas.
-
Basura adentro/basura afuera (Garbage-in/Garbage-out): una revisión sistemática de buena calidad metodológica no está exenta de incluir estudios primarios de mala calidad (garbage in). Esto produce que el resultado de la síntesis de estudios de mala calidad brindará resultados de baja certeza (garbage out) [48].
-
Estudios problemáticos: las revisiones pueden estar sujetas a otros problemas tales como la inclusión de estudios fraudulentos y conflictos de intereses de los autores que pudiesen sesgar los hallazgos [49]. Al igual que los demás problemas a los que se encuentran sujetas las revisiones sistemáticas, han surgido estrategias para mitigarlos como, por ejemplo, el endurecimiento de las políticas editoriales con respecto a los conflictos de interés en los autores de revisiones sistemáticas [50,51].
-
Falta de actualización: el largo tiempo que usualmente toma realizar una revisión sistemática dificulta la inclusión de estudios primarios recientes [52]. Algunos de los desarrollos metodológicos que contrarrestarían este fenómeno incluyen las revisiones sistemáticas vivas (living systematic reviews) que cuentan con actualizaciones periódicas continuas y son descritas in extenso en otro artículo de esta serie metodológica [17].
-
Conflictos de intereses: de la misma manera que la presencia de conflictos de intereses en los autores o financiadores de un estudio primario pueden alterar y sesgar los resultados, las revisiones sistemáticas también son pasibles a este tipo de influencias [53]. Es por esto que Cochrane tiene una de las políticas de conflictos de intereses más estrictas en comparación a otras revistas, lo cual garantiza la independencia de las evaluaciones de los estudios [51].
Como usuarios de revisiones sistemáticas es importante utilizar herramientas que puedan identificar algunos de estos problemas. Las herramientas más conocidas son PRISMA [35] para la calidad del reporte, AMSTAR 2 [9] para calidad metodológica, y ROBIS [54] para la valoración del riesgo de sesgo.
Conclusiones
Las revisiones sistemáticas son un tipo de diseño de investigación que identifica, recopila, evalúa críticamente y sintetiza la evidencia disponible, facilitando a los profesionales de la salud el uso de evidencia para la toma de decisiones. Además, al contar con un protocolo basado en una metodología estructurada para su elaboración permite reducir los sesgos durante la síntesis de información. Por ello, conocer la estructura, los pasos y las limitaciones de las revisiones sistemáticas nos permite una lectura crítica y comprensiva. En este punto es donde el uso de herramientas se vuelve fundamental para identificar y valorar estos problemas.

