Revisión clínica
← vista completaPublicado el 4 de junio de 2021 | http://doi.org/10.5867/medwave.2021.05.8202
Actualidades sobre inmunoterapia para el cáncer renal
Update on immunotherapy for renal cancer
Resumen
En la última década, el desarrollo de inhibidores de puntos de control o checkpoints inmunológicos, ha revolucionado el tratamiento de los pacientes con carcinoma de células renales avanzado avizorándose posibles cambios dramáticos en el escenario terapéutico. Nivolumab, un anticuerpo monoclonal inhibidor de la proteína transmembrana de muerte celular programada 1 (PD-1), se aprobó como monoterapia en 2015 para carcinoma de células renales avanzado en pacientes previamente tratados con algún agente dirigido al factor de crecimiento endotelial vascular. En abril de 2018, la combinación de nivolumab e ipilimumab, un inhibidor del CTLA-4, fue aprobado para pacientes con carcinoma de células renales avanzado de riesgo intermedio y riesgo desfavorable, previamente no tratados. Luego, en 2019, terapias combinadas que consisten en pembrolizumab (anti-PD-1) o avelumab (anti-ligando-PD-1, PD-L1) con axitinib (un inhibidor del receptor tirosina kinasa del factor de crecimiento endotelial vascular); también fueron aprobadas para su uso en todos los grupos de riesgo. En esta revisión se presenta una breve reseña histórica sobre la asociación entre la inmunología y la oncología; se describen aspectos básicos del mecanismo de acción de los inhibidores de puntos de control inmunológicos; se discute la evidencia actual relacionada con el uso clínico de los distintos esquemas de inmu-noterapia para el tratamiento de pacientes con carcinoma de células renales, tanto de células claras como de otros tipos histológicos; y se entrega información general sobre sus efectos adversos. Se analiza el rol de la adecuada selección de pacientes que permita una individualización de la terapia y, por ende, una mejora de los ya promisorios resultados. Por último, se discuten las perspectivas sobre el uso futuro de los inhibidores de puntos de control inmunológicos para el tratamiento del cáncer renal.
|
Ideas clave
|
Introducción
Durante los últimos años se ha producido un auge en el desarrollo de anticuerpos que modulan pasos específicos de la respuesta inmunológica antitumoral, augurando un futuro promisorio en el manejo de diversos tumores sólidos, incluido el carcinoma de células renales.
Anualmente se diagnostican aproximadamente 400 000 nuevos casos de carcinoma de células renales a nivel mundial. Casi un tercio de estos pacientes serán portadores de un tumor localmente avanzado o metastásico [1]. Por otra parte, algunos pacientes operados por un carcinoma de células renales localizado, desarrollarán metástasis. Su evolución variará de pocos meses a varios años, dependiendo de las características clínicas y patológicas de la enfermedad, así como de la respuesta a las terapias.
Esta revisión tiene como objetivo general entregar conceptos básicos sobre el mecanismo de acción de la inmunoterapia moderna para el cáncer renal, además de brindar información relevante y actualizada a los clínicos no expertos en la materia y, como objetivo específico, constituir una ayuda para la toma de decisiones en el manejo de esta patología.
Metodología
Revisión narrativa mediante búsqueda en PubMed/MEDLINE de artículos en inglés y español sobre terapias relacionadas con carcinoma de células renales e inmunoterapia, incluyendo ensayos clínicos, metanálisis, guías clínicas y revisiones de los últimos 10 años, realizada entre el 1 de junio y el 1 de agosto de 2020. Los términos de búsqueda fueron: “RCC”, “renal cell carcinoma”, “Kidney cancer”, “immunotherapy”, “immune checkpoint inhibitor”, “PD-1”, “PD-L1”, “anti-PD-1”, “anti-PD-L1”, “CTLA-4”, “nivolumab”, “ipilimumab”, “pembrolizumab”, “immunotherapy AND biomarkers”, “immunotherapy AND non-clear cell carcinoma”, “adverse events” y “toxicity”. En Google académico/Scholar, se realizó una búsqueda amplia utilizando las frases “inmunoterapia para el carcinoma de células renales”, “inmunoterapia en cáncer renal”, “immunotherapy for renal cancer” y otras similares. De la selección, se buscaron referencias primarias sobre el mecanismo de respuesta inmune antitumoral. En forma dirigida, se revisaron trabajos presentados en congresos de la American Society of Clinical Oncology y materiales de estudio personales (maestría en urooncología) de los últimos dos años. Se excluyeron las publicaciones en idiomas distintos al español e inglés y aquellas no indexadas.
Resultados
A continuación, se presenta una síntesis narrativa subdividida en aspectos históricos y generales de la inmunoterapia y en tópicos sobre el tratamiento del carcinoma de células renales en diferentes escenarios clínicos.
Respuesta inmune antitumoral
La inmunología y la oncología se han vinculado desde fines del Siglo XIX, cuando William Coley informó que la inoculación de bacterias muertas productoras de erisipela en sarcomas podría reducir el tamaño tumoral [2]. Este vínculo se hizo más patente a partir de 1976, cuando Morales y colaboradores demostraron la eficacia del uso intravesical del bacilo de Calmette-Guérin para el manejo del cáncer urotelial [3]. Desde entonces, una mayor comprensión de los mecanismos de vigilancia inmunológica y desarrollo tumoral, han conducido a importantes avances terapéuticos.
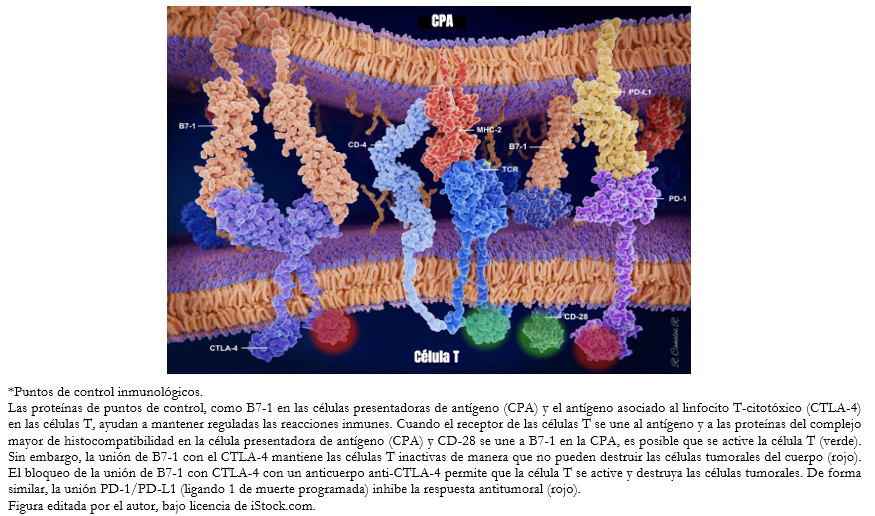
En 2018 recibieron el Premio Nobel de Medicina James Allison, por sus trabajos sobre el desarrollo de anticuerpos que bloquean la acción de la proteína CTLA-4 ubicada en la superficie de los linfocitos T, cuya unión a sus ligandos (CD80 y CD86, o B7.1 y B7.2) se traduce como una inhibición de la activación del linfocito T; y Tasuku Honjo, por sus investigaciones enfocadas en la proteína PD-1 de la superficie de los linfocitos T y cuyo bloqueo mediante anticuerpos favorece la respuesta antitumoral (Figura 1).
 Tamaño completo
Tamaño completo La generación de inmunidad al cáncer es un proceso cíclico en el que participan factores inmunoestimuladores, pero también otros de retroalimentación que pueden detener o limitar la respuesta antitumoral. Este ciclo puede dividirse en siete pasos:
- Comienza con la liberación de antígenos tumorales.
- Estos son presentados por las células presentadoras de antígeno (CPAs).
- Ello conlleva a la activación de las células T.
- Estas se trasladan hacia el tumor.
- Allí lo infiltran.
- Reconocen las células cancerosas.
- Terminan con la destrucción de las células neoplásicas.
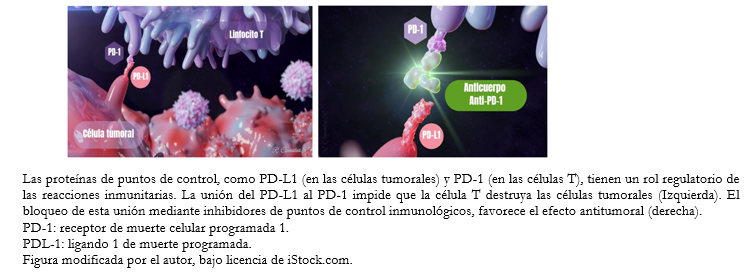
Los numerosos factores que entran en juego, proporcionan una amplia gama de posibles objetivos terapéuticos. Así, los anticuerpos anti-antígeno asociado al linfocito T-citotóxico (CTLA-4) pueden promover el paso 3 y los anti-PD-1/anti-PD-L1 pueden promover el paso 7 [4]. Cuando los linfocitos T reconocen los antígenos de superficie que identifican a una célula como cancerosa se activan para eliminarla, pero también es necesaria una señal de frenado para evitar una sobreactivación. Una de estas vías regulatorias ocurre por el aumento de expresión de receptores de inhibición como el PD-1 por parte de los linfocitos T. Tras la unión del PD-1 a su ligando PD-L1 (normalmente expresado en la superficie de células dendríticas y macrófagos), se produce una reducción de la producción de citoquinas y la supresión de la proliferación de las células T. Es este mecanismo de resistencia inmune adaptativa, mediante aumento del PD-L1, el que han desarrollado muchos tumores para continuar proliferando.
En contraposición, la inmunoterapia pretende superar la capacidad de las células neoplásicas de resistir esta respuesta antitumoral. Así, una molécula capaz de bloquear el PD-1 presente en los linfocitos, o bien los ligandos PD-1 expresados por las células cancerosas, impedirá la unión de ambos y bloqueará la señal inmunomoduladora, permitiendo que las células T continúen activas contra el tumor (Figura 2).
 Tamaño completo
Tamaño completo De este modo, los anticuerpos anti-PD-1, anti-PD-L1 y anti-CTLA-4 se han postulado como la gran promesa en el ámbito de la inmunoterapia contra el cáncer. Estos inhibidores de puntos de control inmunológicos se han convertido en una nueva modalidad para el manejo del carcinoma de células renales avanzado, desplazando a las citoquinas como la interleucina -2 o el interferón -a, cuyos resultados eran pobres [5].
Inhibidores de puntos de control inmunológicos
El nivolumab, un anticuerpo anti-PD-1, fue aprobado en 2015 por la Administración de Alimentos y Medicamentos de Estados Unidos (Food and Drug Administration, FDA) y en 2016 en Europa, como segunda línea de tratamiento después del uso de antiangiogénicos para carcinoma de células renales avanzado, basado en mejoras en la sobrevida global en el ensayo de fase III CheckMate 025. Posteriormente, la combinación de nivolumab más ipilimumab (anticuerpo monoclonal de tipo inmunoglobulina G1κ frente a CTLA-4) en pacientes sin tratamiento previo, también se aprobó e incorporó a las guías clínicas, basado en otro ensayo fase III (CheckMate 214). Adicionalmente, en 2019 la FDA aprobó la combinación de pembrolizumab (anti-PD-1) más axitinib, un inhibidor de receptores tirosincinasa del factor de crecimiento endotelial vascular (VEFG), así como también avelumab (anti-PD-L1) en combinación con axitinib, para el tratamiento de primera línea de pacientes con carcinoma de células renales avanzado [6].
Efectos adversos relacionados con inmunoterapia
Los inhibidores de puntos de control inmunológicos se asocian con un espectro particular de efectos adversos. Estos pueden involucrar virtualmente cualquier órgano, con toxicidades que incluyen endocrinopatías, diarrea/colitis, dermatitis, hepatitis, neumonitis y nefritis intersticial. Se suman cefalea, pérdida de peso, trastornos hematológicos y dolor articular, entre otros. Sin embargo, el efecto adverso vinculado a inmunoterapia más comúnmente reportado es la fatiga, en ocasiones severa. Generalmente los efectos adversos relacionados a inmunoterapia son transitorios y leves, aunque ocasionalmente pueden ser severos y prolongados. El manejo de estos últimos requerirá la interrupción de la inmunoterapia y la utilización de corticoesteroides [7].
Específicamente, la seguridad y la actividad de los inhibidores de puntos de control inmunológicos en pacientes con trastornos autoinmunes, con infecciones virales crónicas, con tratamientos inmunosupresores, en portadores de metástasis cerebrales o en embarazadas, no están bien establecidas. En los receptores de un trasplante de órgano sólido, están contraindicados [8].
Tratamiento
En la actualidad, los tratamientos inmunoterápicos se están posicionando como una indicación de primera línea en el manejo del carcinoma de células renales avanzado, y se está explorando qué combinaciones de inhibidores de puntos de control inmunológicos o de estos asociados a terapias dirigidas, pueden otorgar mejores resultados en distintos escenarios clínicos [6].
Recientemente, se han evaluado combinaciones de antiangiogénicos más inhibidores de puntos de control inmunológicos. La racionalidad biológica para estas combinaciones se origina en estudios preclínicos en modelos que incluían tumores distintos a células claras y otros tipos de cánceres, pero que sugieren que los agentes anti-factor de crecimiento endotelial vascular pudiesen potenciar la inmunidad antitumoral estimulando la función de las células presentadoras de antígenos y la infiltración de células inmunes al tumor, además de disminuir el efecto de las células supresoras de linaje mieloide y de los macrófagos en el microambiente tumoral [9],[10],[11].
Las terapias dirigidas tienen efectos inmunomoduladores dentro del microambiente tumoral, promoviendo que las células T reguladoras, las células supresoras de linaje mieloide y las citocinas, supriman una evasión inmune por parte de las células neoplásicas. Por lo tanto, una combinación de ambas terapias podría tener una actividad sinérgica. Entre las terapias dirigidas se incluyen aquellas que bloquean la angiogénesis tumoral vía inhibidores de tirosincinasas del factor de crecimiento endotelial vascular como sunitinib, axitinib, cabozantinib, sorafenib y pazopanib; los inhibidores de diana de rapamicina (temsirolimus, everolimus); y los anticuerpos monoclonales anti-factor de crecimiento endotelial vascular (bevacizumab). La evidencia actual se respalda principalmente en la racionalidad fisiopatológica y en estudios retrospectivos, a falta de suficientes ensayos clínicos aleatorizados. Por esto, presentaremos por separado datos correspondientes a distintos subgrupos de pacientes y contextos clínicos, integrando además información de las guías clínicas de la Asociación Europea de Urología (AEU) [12]; European Society for Medical Oncology (ESMO) [13]; National Comprehensive Cancer Network (NCCN v2.2020) [14]; y de la Society for Immunotherapy of Cancer (SITC) [15]. En tal contexto, el tratamiento estará definido sobre la base de la categorización del pronóstico de cada paciente.
Estratificación de riesgo
La elección del tratamiento debe considerar los factores de riesgo pronóstico sobre carcinoma metastásico de células renales del International Metastatic Renal Cell Carcinoma Database Consortium (IMDC) [16]. Este modelo pronóstico integra seis factores adversos. Los pacientes con cero factores de riesgo se consideran con bajo riesgo, aquellos con uno o dos se consideran de riesgo intermedio, y aquellos con tres o más factores se consideran con riesgo desfavorable. Estos factores de riesgo son:
- Índice de Karnofsky (KPS) inferior a 80%.
- Tiempo desde el diagnóstico hasta el tratamiento inferior a 1 año.
- Concentración de hemoglobina menor al límite inferior de lo normal.
- Calcio sérico mayor al límite superior de lo normal.
- Recuento de neutrófilos superior al límite superior de lo normal.
- Recuento de plaquetas mayor al límite superior de lo normal.
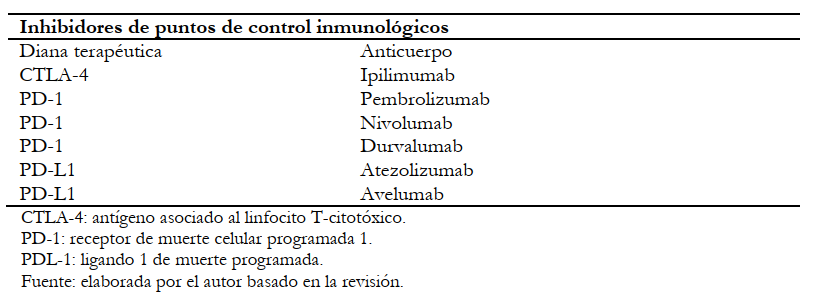
En la Tabla 1, se muestran los principales inhibidores de puntos de control inmunológicos actualmente utilizados.
 Tamaño completo
Tamaño completo Vigilancia activa
En pacientes asintomáticos con una carga de enfermedad limitada y sin elementos de mal pronóstico, la vigilancia activa puede representar una alternativa en quienes deseen diferir el inicio de la terapia y su toxicidad concomitante, hasta que se documente una progresión [12].
Inmunoterapia en primera línea
Los datos convincentes sobre el papel de la inmunoterapia en pacientes no tratados provino de un ensayo fase III que demostró un beneficio en sobrevida global con la combinación de nivolumab más ipilimumab sobre sunitinib [17]. Posteriormente, pembrolizumab más axitinib demostraron beneficios en sobrevida libre de progresión y sobrevida global sobre sunitinib [18]. De este modo, para aquellos pacientes con riesgo intermedio o desfavorable, las opciones preferidas incluyen nivolumab más ipilimumab o pembrolizumab más axitinib. Avelumab más axitinib es una opción alternativa, pero hasta ahora no ha demostrado un beneficio de sobrevida global en ensayos aleatorizados.
Nivolumab más ipilimumab: en el ensayo fase III CheckMate 214, 1096 pacientes con carcinoma de células renales metastásico de células claras, con o sin tratamiento previo; se asignaron aleatoriamente a nivolumab más ipilimumab versus sunitinib. Fueron excluidos los pacientes con metástasis cerebrales y exposición previa a terapia dirigida o a un inhibidor de puntos de control. Con una mediana de seguimiento de 25 meses, los resultados incluyeron lo siguiente: para toda la población de estudio por intención de tratar, la sobrevida global aumentó con nivolumab más ipilimumab (mediana no alcanzada versus 32,9 meses; Hazard ratio: 0,68; intervalo de confianza: 99,8%: 0,49 a 0,95). La tasa de respuesta objetiva también aumentó (39% versus 32). Para los 847 pacientes con enfermedad de riesgo intermedio o desfavorable, hubo una significativa mejoría en la sobrevida global con nivolumab más ipilimumab (mediana no alcanzada versus 26 meses, Hazard ratio 0,63; intervalo de confianza 95%: 0,44 a 0,82) y en la tasa de respuesta objetiva, en comparación con sunitinib (42 versus 27%), con una sobrevida libre de progresión más larga, aunque no estadísticamente significativa. Los efectos adversos ocurrieron en 93% de los pacientes tratados con nivolumab más ipilimumab y en 97% de los tratados con sunitinib. Los eventos de grado 3 ó 4 ocurrieron en 250 (46%) y 335 pacientes (63%), respectivamente. Los efectos adversos relacionados a inmunoterapias que llevaron a la interrupción del tratamiento ocurrieron en 22% del grupo de nivolumab más ipilimumab y en 12% del grupo de sunitinib. Se informaron 8 muertes relacionadas con el tratamiento en el grupo de nivolumab más ipilimumab y 4 en el grupo de sunitinib [17]. Un reporte actualizado a 2019, con una mediana de seguimiento de 32,4 meses; muestra persistencia de los beneficios en tasa de respuesta objetiva en todos los grupos de riesgo [19].
Axitinib más pembrolizumab: en el ensayo fase III KEYNOTE-426, 861 pacientes con carcinoma de células renales metastásico de células claras avanzado, sin tratamiento previo, fueron asignados aleatoriamente a pembrolizumab más axitinib versus sunitinib [18]. Después de una mediana de seguimiento de 13 meses, el pembrolizumab más axitinib mostró beneficios independientemente de la expresión de PD-L1 y de la clasificación de riesgo. Los datos actualizados de este estudio, con 27 meses de seguimiento, continúan mostrando beneficios en todos los grupos de riesgo y subgrupos de expresión de PD-L1, con una sobrevida global a 24 meses de 74% para pembrolizumab más axitinib versus 66% para sunitinib. Además, los pacientes con tasa de respuesta objetiva igual o mayor a 80% muestran una sobrevida global similar a la de los pacientes con respuesta completa, según criterios RECIST v1.1 [20]. Por otro lado, las cifras de otro estudio que evalúa axitinib más pembrolizumab en carcinoma de células renales avanzado; luego de 5 años de seguimiento desde su fase 1, muestran que un 73% de los pacientes siguen vivos, con una probabilidad de estar vivo al año de 96% y a los 3 años de un 82%; con una sobrevida libre de progresión de 23,5 meses (intervalo de confianza 95%; 15,4 a 30,4) y una media de duración de respuesta de 22,1 meses. Así, esta combinación continúa demostrando un beneficio clínico, sin alcanzarse aún la mediana de sobrevida global [21].
Otras estrategias: el ensayo fase III JAVELIN Renal-101 mostró que avelumab más axitinib mejora significativamente la sobrevida libre de progresión en comparación con sunitinib [22]. Un segundo análisis interino, con un seguimiento mínimo de 13 meses, muestra un Hazard ratio de 0,69 (intervalo de confianza 95%: 0,574 a 0,825; p < 0,0001) con una sobrevida libre de progresión de 13,3 (intervalo de confianza 95%: 11,1 a 15,3) versus 8,0 meses (6,7 a 9,8) [23]. Es una opción en primera línea, aunque se prefieren nivolumab más ipilimumab o axitinib más pembrolizumab, a falta de datos maduros de sobrevida global en la que no se demostró diferencias estadísticamente significativas.
El pembrolizumab como agente único se está estudiando en el ensayo KEYNOTE-427. Se trata de un estudio fase II, abierto, de un solo brazo, en pacientes con carcinoma de células renales avanzado de células claras (cohorte A) y de histología distinta a células claras (cohorte B). En la cohorte A, 110 pacientes con carcinoma de células renales de células claras avanzado o metastásico fueron tratados con pembrolizumab (200 miligramos cada tres semanas), todos tenían una enfermedad medible (RECIST v1.1) y no habían recibido previamente terapia sistémica. Los resultados preliminares presentados en 2018, con una mediana de seguimiento de 12 meses, mostraron una tasa de respuesta objetiva de 38,2% (3 respuestas completas y 39 respuestas parciales). La respuesta fue mayor en pacientes con enfermedad de riesgo intermedio/desfavorable que en aquellos con enfermedad de bajo riesgo (42 versus 32%) [24]. Los resultados actualizados de esta cohorte presentados en el congreso de la American Society of Clinical Oncology 2020, con una mediana de seguimiento de 23,1 meses (16,7 a 27,5), muestran que los pacientes con una reducción de la carga tumoral mayor a 80%, tienen una sobrevida global a largo plazo comparable con aquellos que tuvieron una respuesta completa [25].
En el estudio fase III IMotion151, se observaron ciertas ventajas en sobrevida libre de progresión (p = 0,021) con atezolizumab más bevacizumab en la población PD-L1 (+), pero no se demostró una mejoría en la sobrevida global en comparación con sunitinib, por lo que hasta ahora no existe evidencia sólida que sustente su uso en carcinoma de células renales de células claras avanzado, salvo en histología sarcomatoide donde hubo mejores resultados [26].
En cuanto a combinaciones de mayor potencial sinérgico, el estudio COSMIC-313, aleatorizado, doble ciego y controlado, fase III evaluará en pacientes con carcinoma de células renales de células claras de riesgo intermedio y desfavorable no tratados, el uso de cabozantinib (inhibidor multicinasa) en combinación con nivolumab más ipilimumab (~338 pacientes en cada brazo). Dicho estudio inició su enrolamiento a mediados de 2019 y sus primeros resultados se esperan para fines de 2021 [27].
Alternativas en pacientes previamente tratados con antiangiogénicos
Para aquellos pacientes que progresan al tratamiento con antiangiogénicos sin exposición previa a inhibidores de puntos de control inmunológicos, la evidencia respalda el tratamiento con nivolumab. Este anticuerpo mejora la sobrevida global en comparación con everolimus en esta población. En el ensayo fase III CheckMate 025, 821 pacientes fueron asignados aleatoriamente a nivolumab o everolimus. Todos los pacientes habían recibido una o dos terapias antiangiogénicas previas28. En el reporte actualizado, con un seguimiento de 64 meses, los pacientes tratados con nivolumab continúan demostrando un beneficio en sobrevida global estando el 28% de los pacientes vivos a 5 años en comparación con el 18% de los tratados con everolimus. Además, el porcentaje de pacientes que experimentaron una respuesta objetiva fue del 23% frente al 4% para everolimus, y la mediana de duración de la respuesta para nivolumab también se mantuvo por más tiempo (18,2 versus 14 meses)29.
Opciones ante la falla a inmunoterapia
Para estos pacientes, los estudios sugieren terapia dirigida al factor de crecimiento endotelial vascular en lugar de un inhibidor de diana de rapamicina. Las opciones incluyen axitinib, cabozantinib, sunitinib, pazopanib o lenvatinib con everolimus [5]. Al respecto, existe un informe sobre resultados con receptores de tirosincinasa, después del fracaso de nivolumab más ipilimumab en carcinoma de células renales metastásico, como parte del ensayo CheckMate 214. La mediana de sobrevida libre de progresión con receptores de tirosincinasa de primera generación (sunitinib/pazopanib) y de segunda generación (axitinib/cabozantinib) fue de 8 y 7 meses, respectivamente. Estas medianas sugieren un beneficio sostenido de receptores de tirosincinasa y respalda las investigaciones sobre secuenciación óptima [30].
En forma interesante, en este escenario de progresión, se ha evaluado el uso de un segundo inhibidor de puntos de control inmunológicos. Así, un estudio multicéntrico que incluyó 65 pacientes concluyó que la tasa de respuesta objetiva del inhibidor de puntos de control inmunológicos-2 fue de 23%, lo cual es comparable a lo visto con inhibidores de puntos de control inmunológicos después del uso de terapia dirigida. Esto se observó incluso con inhibidores de puntos de control inmunológicos en monoterapia y la probabilidad de respuesta fue mayor en los pacientes que habían respondido inicialmente al inhibidor de puntos de control inmunológicos-1 [31].
Inmunoterapia en carcinoma de células renales de histología distinta a células claras
Escasean los datos respecto a la eficacia de los inhibidores de puntos de control inmunológicos en carcinoma de células renales de histología distinta a células claras, y en carcinoma de células renales de células claras con variantes sarcomatoides o rabdoides. Recientemente, pequeñas series han demostrado beneficios en estos casos [32]. Al respecto, en un estudio multicéntrico fase II, se evaluó el uso de atezolizumab más bevacizumab y se objetivó una tasa de respuesta objetiva de 33% y 50% en pacientes con carcinoma de células renales con diferenciación sarcomatoide y con variantes histológicas, respectivamente [33]. En el mismo sentido, 142 pacientes (16%) del estudio IMmotion151 tenían tumores con algún componente de histología sarcomatoide. En él, un análisis de subgrupo mostró que estos pacientes tuvieron sobrevida global y sobrevida libre de progresión más largas y una tasa de respuesta objetiva/respuesta completa más alta, cuando se trataron con atezolizumab más bevacizumab en vez de sunitinib (tasa de respuesta objetiva de 49% versus 14% y una tasa de respuesta completa del 10% versus 3%) [34].
Por otro lado, los resultados de la cohorte B del ensayo KEYNOTE-427 muestran resultados prometedores con pembrolizumab como primera línea en carcinoma de células renales de histología distinta a células claras. La tasa de respuesta objetiva en la población general fue del 24,8%, ligeramente mejor en papilar (25,4%) y no clasificada (34,6%) y peor en cromófobo (9,5%) [35]. Los datos actualizados presentados en el congreso de la American Society of Clinical Oncology 2020, muestran que una reducción de la carga tumoral mayor a 30% se correlaciona con una mejor sobrevida, llegando a ser equivalente a la de los pacientes con remisión completa si esta reducción es mayor a 80%, según criterios RECIST v1.1 [36].
Cabe mencionar el estudio fase I/II CALYPSO, de un solo brazo, que evalúa la eficacia de durvalumab más savolitinib (inhibidor del protoncogen MET) en pacientes con carcinoma de células renales metastásico variante papilar, independientemente de si habían recibido tratamiento previo o no. Sus avances fueron presentados en el congreso de la American Society of Clinical Oncology GU 2020. En este ensayo, la tasa de respuesta objetiva de durvalumab más savolitinib fue del 27%, con una mediana de sobrevida libre de progresión de 5,3 meses [37]. SUNNIFORECAST es un ensayo europeo multicéntrico prospectivo aleatorizado fase II que evalúa el uso de nivolumab más ipilimumab versus cuidados estándares (sunitinib) en pacientes con carcinoma de células renales de histología distinta a células claras, cuyas biopsias son revisadas por un patólogo de referencia, estratificado según todos los grupos de riesgo del International Metastatic Renal Cell Carcinoma Database Consortium e histología papilar o no papilar. En la fase I, nivolumab más ipilimumab demostró una tasa de respuesta objetiva sustancialmente mayor que cualquier agente único. Su enrolamiento está en progreso y tiene como objetivo primario la sobrevida global a 12 meses (n » 306) [38].
Síntesis general de esquemas terapéuticos del carcinoma de células renales
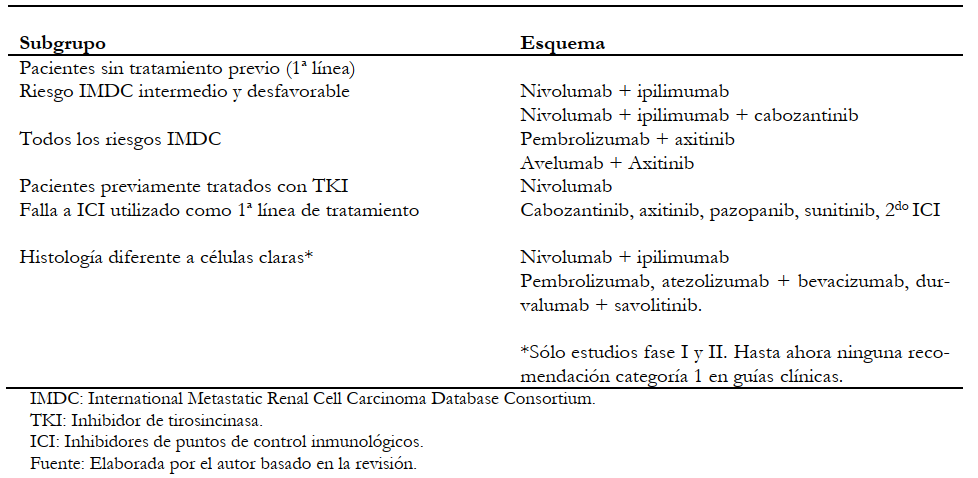
En la Tabla 2, se muestra un resumen de los esquemas de inmunoterapia con sus principales recomendaciones. El rol de los niveles de expresión tumoral de biomarcadores (como, por ejemplo, los niveles de PD-L1) no está bien establecido, por lo que no se han incluido dentro del análisis de decisión de manejo.
 Tamaño completo
Tamaño completo Discusión
La inmunoterapia ha demostrado beneficios por sobre la terapia estándar. Sin embargo, todavía no está claro qué pacientes se benefician más de combinaciones ni cuál es la secuenciación óptima. Es por esto que se están desarrollando estudios adaptativos de fase III [39].
En la medida que existan más opciones terapéuticas, más complejo puede tornarse el análisis que permita escoger una opción de manejo sobre otra. Ante esto, es importante establecer sucesiones terapéuticas que permitan un equilibrio entre el beneficio de sobrevida y la toxicidad. Al respecto, Dizman y colaboradores proponen un algoritmo de secuenciación que, a grosso modo, plantea como primera línea nivolumab más ipilimumab, o en su defecto pembrolizumab más axitinib, para los pacientes con carcinoma de células renales avanzado de células claras o con histología sarcomatoide. Después del fracaso a la inmunoterapia, la secuencia sería cabozantinib, seguido de lenvatinib/everolimus si existe progresión. Se aconseja nivolumab en segunda línea, para pacientes vírgenes a inmunoterapia [40].
Finalmente, dados los beneficios de la inmunoterapia en carcinoma de células renales avanzado y ante la ausencia de una terapia estándar de adyuvancia luego del tratamiento quirúrgico en carcinoma de células renales no metastásico, ya están en marcha estudios fase III que comparan el uso de inhibidores de puntos de control inmunológicos versus observación. Tal es el caso para nivolumab [41] y para pembrolizumab [42], ambos en monoterapia. De esta forma, se espera que en los próximos años se expandan las indicaciones de la inmunoterapia en cáncer renal. Además, es probable que el desarrollo de marcadores genéticos o moleculares y la identificación de predictores de resultados oncológicos ayuden a una óptima selección de pacientes y esquemas de tratamiento, consolidando a la inmunoterapia como un nuevo estándar de manejo.
Fortalezas y limitaciones de este estudio
No se encontraron revisiones sistemáticas recientes sobre el tema en The Cochrane Library, siendo la única accesible una revisión actualizada a mayo de 2017, por lo que sólo incluye datos inmaduros sobre nivolumab en carcinoma de células renales avanzado y básicamente evaluó esquemas antiguos basados en interferón-a. Por otra parte, se encontraron tres protocolos en el registro prospectivo internacional de revisiones sistemáticas PROSPERO (International Prospective Register of Systematic Reviews): uno que evalúa los inhibidores de puntos de control inmunológicos en carcinoma de células renales metastásico sin tratamiento previo [43], otro respecto a la eficacia y seguridad de los inhibidores de puntos de control inmunológicos combinados con antiangiogénicos como tratamiento de primera línea en carcinoma de células renales metastásico [44], y otro que evalúa la inmunoterapia versus las terapias dirigidas para el tratamiento del carcinoma de células renales avanzado [45]; todos en etapa inicial, sin resultados aún. Ante esta actual falencia de metanálisis y revisiones sistemáticas, creemos que la presente revisión, a pesar de su naturaleza narrativa no sistemática con sus limitaciones y sesgos inherentes, entrega una perspectiva histórica y una visión global sobre el tema que brinda información valiosa que permite fundamentar decisiones terapéuticas modernas, especialmente útil para quienes se están introduciendo en este ámbito de estudio.
Conclusiones
En términos generales, basados en los estudios publicados, todo paciente con un cáncer renal avanzado debiera considerarse eventual candidato a inmunoterapia con inhibidores de puntos de control inmunológicos. De esta forma, toma relevancia el conocer los aspectos fisiopatológicos básicos, la evidencia acumulada y los efectos adversos relacionados a los inhibidores de puntos de control inmunológicos, para evaluar adecuadamente los escenarios clínicos en los que estos configuren una opción, bajo un contexto de expectativas racional.
Notas
Roles de contribución
RCR es el único autor de este artículo.
Conflictos de intereses
El autor refiere no tener conflictos de interés y haber completado el formulario del IMCJE. Además declara no haber recibido financiamiento para la realización del artículo publicado; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado y no tener otras relaciones o actividades que podrían influir sobre el artículo.
Financiamiento
El autor declara que no hubo fuentes de financiamiento externas.
Consideraciones éticas
Debido a la naturaleza del estudio, no requirió de la evaluación de un comité de ética.

