Artículo de revisión
← vista completaPublicado el 13 de julio de 2023 | http://doi.org/10.5867/medwave.2023.06.2708
Herramientas de la medicina genómica para la práctica clínica: el ejemplo de la psiquiatría
Tools of genomic medicine for clinical practice: The example of psychiatry
Resumen
La mayoría de los trastornos psiquiátricos tienen una heredabilidad de moderada a alta, con diferentes arquitecturas genéticas. Aunque la investigación genética en psiquiatría ha tenido un avance progresivo, sus hallazgos, interpretación e impacto en la psiquiatría clínica resultan desconocidos para la mayoría de los profesionales de salud mental. En este artículo se abordan conceptos clave sobre genética para el entendimiento de algunas entidades clínicas, con énfasis en la nomenclatura genética y los tipos de mutaciones. Particularmente, se plantea el rol de la herencia en los inicios de la investigación genética en psiquiatría, los diseños de estudio más utilizados y sus principales objetivos. Por otro lado, se revisan algunas bases de datos genéticas y genómicas que pueden ser de utilidad para la práctica clínica. Entre ellas destacan , ClinVar, Ensembl y . Finalmente, se plantea una viñeta clínica en donde es posible aplicar algunas de las herramientas de la medicina genómica. Debido a que la evidencia en genética psiquiátrica se basa en estudios realizados en poblaciones con origen ancestral europeo o norteamericano, es de suma relevancia desarrollar estudios locales para incrementar el conocimiento y la aplicación de la medicina genómica sobre poblaciones subrepresentadas.
Ideas clave
- La base genética de los trastornos psiquiátricos es significativa, pero no necesariamente fácil de detectar.
- La medicina genómica ya puede utilizarse en la práctica psiquiátrica; algunas de sus aplicaciones son sencillas de implementar y deberían ser empleadas universalmente, como el registro de la genealogía familiar, mientas que otras más complejas y específicas se aplican a casos seleccionados.
- Una gran parte de la evidencia disponible descansa sobre descubrimientos hechos en poblaciones de origen europeo, lo que limita su generalización a una población mestiza como la chilena.
- En este artículo se entregan algunas herramientas de la genética que pueden ser usadas en atención clínica en psiquiatría, incluyendo conceptos clave, tipos de estudios de utilidad en psiquiatría y bases de datos genéticas.
Introducción
La genética es el estudio científico de los genes y la herencia. Prácticamente todas las enfermedades en el humano tienen alguna contribución de factores hereditarios. En el caso de las enfermedades psiquiátricas en particular, se cumple que la mayoría de los trastornos que enfrentan los clínicos tienen una heredabilidad de moderada a alta [1], con diferentes patrones de combinación de factores causales o “arquitecturas genéticas” [2]. Sin embargo, las manifestaciones clínicas utilizadas para establecer un diagnóstico obedecen a un análisis descriptivo que se basa en las clasificaciones psiquiátricas vigentes, tales como el Diagnostic And Statistical Manual Of Mental Disorders, Fifth Edition, Text Revision (DSM-5-TR) [3] y la Clasificación Internacional de Enfermedades, 11° edición (CIE-11) [4]. Estas no reflejan directamente la neurobiología de los trastornos descritos, lo que dificulta el descubrimiento de los factores genéticos subyacentes.
La práctica de la psiquiatría se basa fundamentalmente en el examen mental y la historia clínica. En este sentido, la realización de una anamnesis exhaustiva, particularmente sobre los antecedentes familiares, sigue siendo un elemento fundamental para la sospecha e identificación del riesgo de presentar algún trastorno psiquiátrico. Recientemente se han ido incorporando cada vez más a la práctica clínica algunas herramientas tecnológicas basadas en la biología molecular y el conocimiento sobre el genoma humano. Ejemplo de ello es el uso de pruebas genéticas, cuya validez y aplicabilidad clínica han sido demostradas para algunos trastornos del neurodesarrollo [5] y neurodegenerativos [6]. Para poder aproximarse a su aplicación, así como para poder seguir los desarrollos científicos de forma crítica, es necesario tener algunas nociones acerca de la variación genética y su relación con las diferencias interindividuales en la conducta.
La investigación genética, especialmente la investigación genómica en psiquiatría, ha aumentado progresivamente a nivel mundial. Este avance no ha sido equitativo, ya que se basa fundamentalmente en estudios desarrollados en poblaciones de origen europeo [7]. La escasa representación de individuos con otros orígenes ancestrales tiene implicancias para la aplicabilidad de los datos [8]. Asimismo, este hecho influye en la forma en que los profesionales de salud mental se informan, analizan e intervienen sobre los hallazgos en esta área [9]. En el caso de Chile, existe un déficit en cuanto a la información genética local. Sin embargo, existen algunas iniciativas que buscan aportar a la brecha de evidencia. Particularmente, el proyecto Chile Genómico, conformado por un equipo científico multidisciplinario, busca producir una primera caracterización sistemática de la población chilena a nivel genómico [10].
En esta revisión se abordan algunos conceptos generales sobre genética, su aplicabilidad en psiquiatría y el uso de herramientas como las bases de datos genéticas y genómicas que pudiesen ser de utilidad en la práctica clínica. Además, se presenta un caso clínico estereotípico, formulado para el propósito de este artículo, que permite a psiquiatras y profesionales de la salud mental familiarizarse con las herramientas de las que dispone la medicina genómica. En una próxima publicación, podremos profundizar en la aplicación de estas herramientas.
Conceptos generales en genética
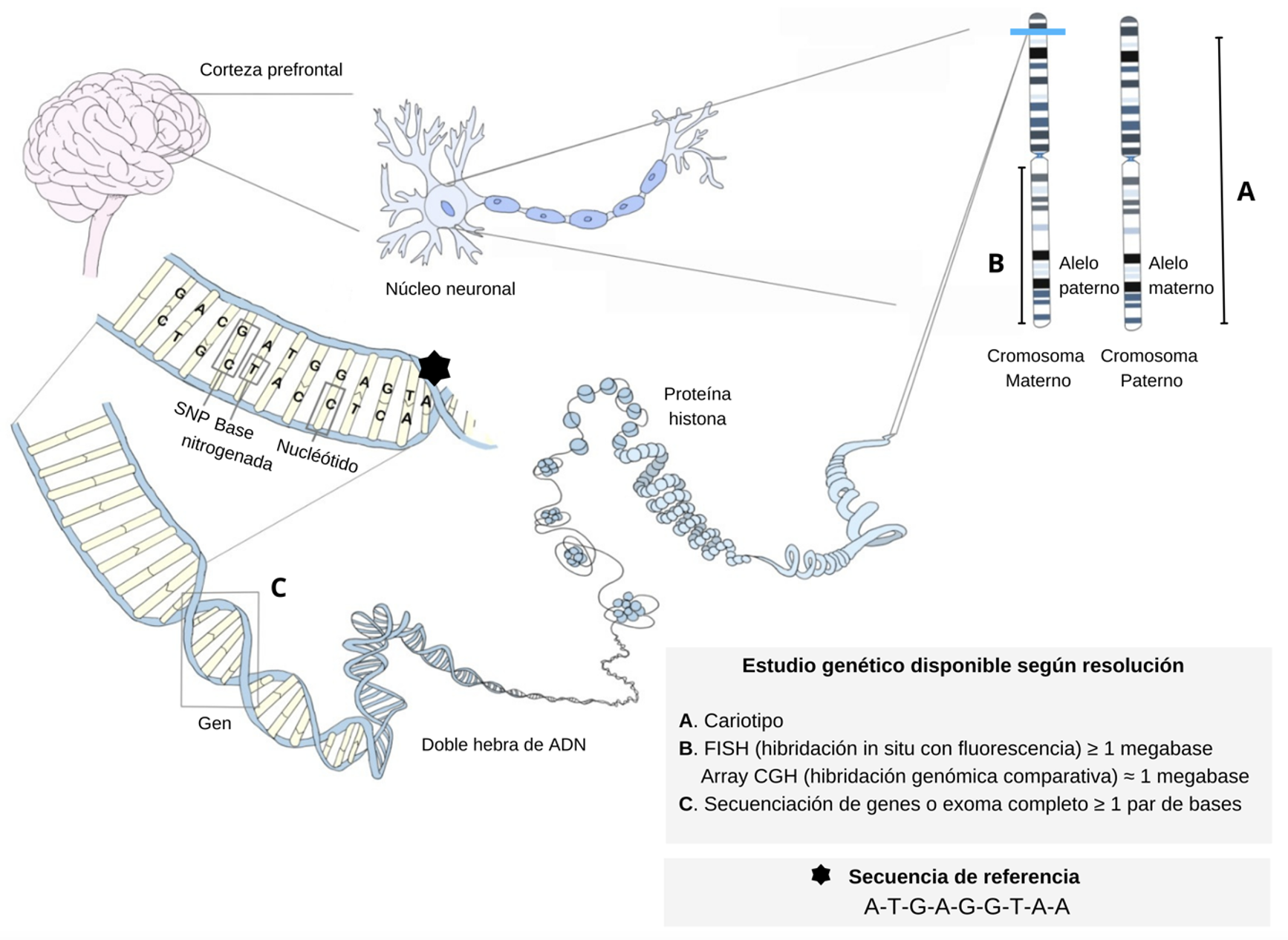
El material genético está contenido en el ácido desoxirribonucleico (ADN), molécula compuesta por una secuencia de nucleótidos que se sitúa en el núcleo celular y en la mitocondria. Durante la proliferación celular, el ADN se replica para producir moléculas idénticas, luego se transcribe para sintetizar moléculas de ácido ribonucleico (ARN) que finalmente serán traducidas en el citoplasma en secuencias aminoacídicas que conforman proteínas [11]. Esta secuencia de hechos fue conocida como el “dogma de la biología molecular”. No obstante, hoy se sabe que el flujo de información no solo sigue este sentido, pues existen ejemplos en donde a partir de una molécula de ARN puede sintetizarse una de ADN, dando cuenta de la complejidad de los fenómenos biológicos [12]. Las moléculas de ADN se condensan en cromosomas, que en la especie humana corresponden a 23 pares homólogos, provistos en un 50% por el padre y un 50% por la madre del individuo.
La unidad funcional básica de la herencia es el gen, que corresponde a una secuencia de ADN encargada de codificar un producto en específico [13]. Se estima que en la especie humana existen alrededor de 20 000 genes nucleares y 37 genes mitocondriales [14,15]. Cada ser humano presenta dos copias de cada gen ubicadas en cada cromosoma homólogo. Estas copias se denominan alelos, y corresponden a un alelo materno y uno paterno. Alrededor del 1% de los genes codifica proteínas; el resto participaría en funciones estructurales y regulatorias de la expresión génica [11].
Existe una serie de conceptos utilizados en genética de gran relevancia para la comprensión de las entidades clínicas. En el Cuadro 1 se describen algunos de ellos, ilustrándose en la Figura 1.
Variante de un gen que se hereda por la madre o el padre. Entre sí, los alelos presentan diferencias en sus secuencias nucleotídicas. La forma ancestral de un alelo en la población se conoce como “alelo silvestre” o
Posición particular en que se encuentra una secuencia específica de ADN en un cromosoma. Puede contemplar desde un único nucleótido hasta múltiples genes. La forma plural de
Agrupación física de variantes genómicas que tienden a heredarse en conjunto. Por lo tanto, un haplotipo específico suele reflejar una combinación única de variantes situadas de manera próxima en un cromosoma [19]. A propósito, una investigación estudió a adultos con trastorno depresivo mayor. Los resultados indicaron que los portadores del haplotipo de alelos T-A-T en el gen que codifica el receptor tipo 1 del factor liberador de corticotropina, tuvieron un peor rendimiento neurocognitivo [20].
Variantes génicas que se producen por el cambio de un único nucleótido en un
Repeticiones en la secuencia nucleotídica que incluyen iteraciones de segmentos de tamaño considerable (un gen o varios genes). Se ha planteado que una parte significativa del genoma podría corresponder a variantes del número de copias. En esquizofrenia, múltiples variantes del número de copias han sido implicadas en su fisiopatología, entre ellas la 3q29 [22].
Fuente: elaborado por los autores.
Estructura del material genético y estudios según el nivel de análisis o resolución.
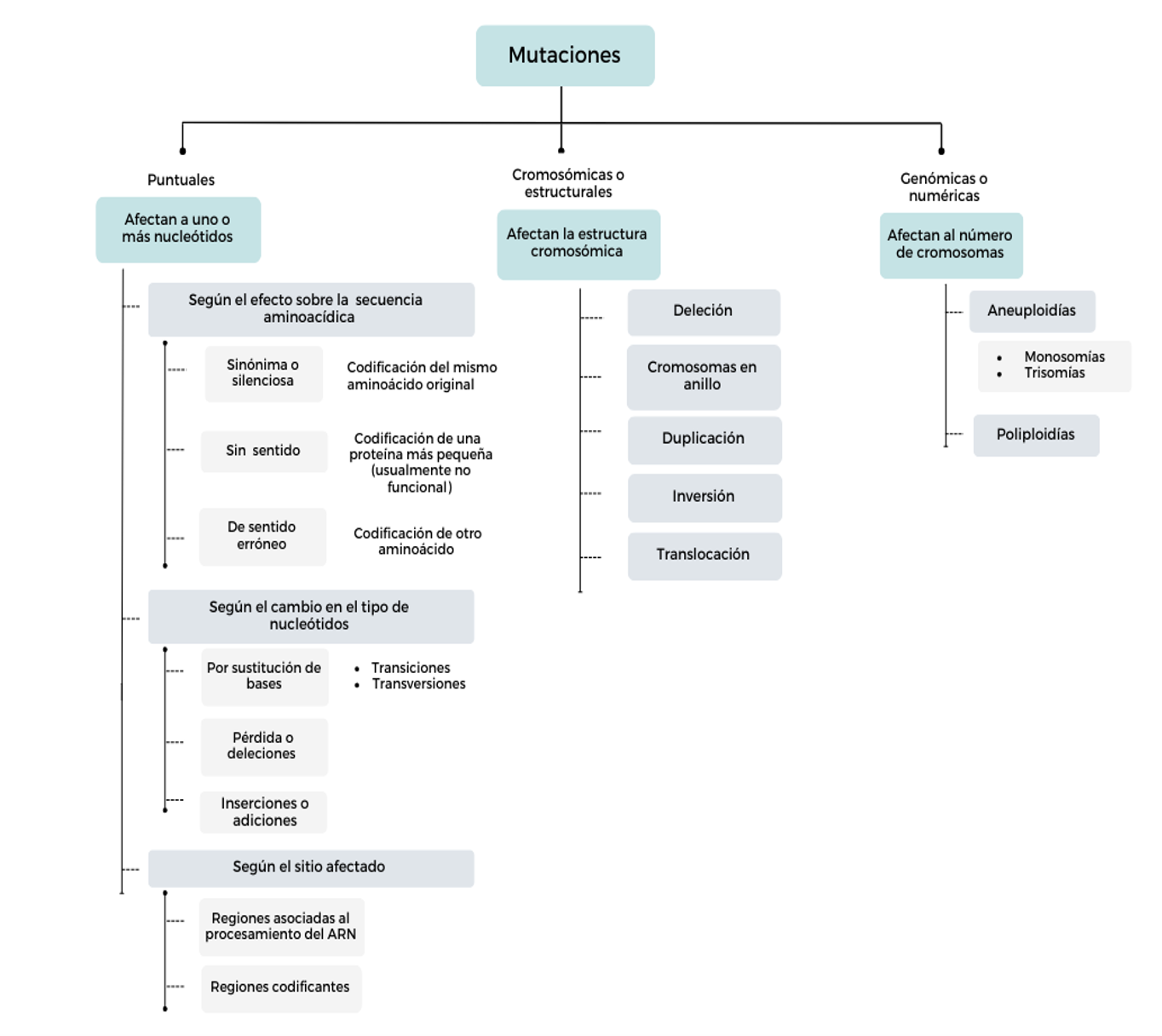
Mutaciones
Los seres humanos compartimos cerca del 99% de la secuencia de ADN [14]. Las diferentes variantes genéticas que existen en la población surgen a partir de mutaciones, esto es cambios permanentes en la secuencia de ADN que se heredan o se adquieren. Involucran desde un único nucleótido hasta largas secuencias nucleotídicas. Las mutaciones son desencadenadas por errores en la replicación y reparación del ADN (espontáneas) o por agentes mutágenos, pero no todas ellas tienen una repercusión funcional [23]. En efecto, la mayoría de las mutaciones no revisten implicancias patológicas y pueden llegar a hacerse parte del pool genético de la población. Si la variante presenta una frecuencia superior al 1% en la población, se denomina “polimorfismo” (Cuadro 1) [24,25]. En la literatura publicada existen distintas taxonomías de mutaciones. En la Figura 2 se presenta una de ellas, que considera criterios de tamaño del cambio observado y efecto sobre el producto o fenotipo.
Genómica y psiquiatría
La genómica es una disciplina con un origen muy reciente. Se dedica al estudio del genoma completo de un organismo, considerando su contenido, estructura y función [11,28]. En la genómica confluyen otras disciplinas como la bioestadística y la bioinformática [28]. Específicamente en psiquiatría, su aplicación es más incipiente.
La relación entre los trastornos psiquiátricos y la genética fue planteada a mediados del siglo XIX por Morel y Maudsley, quienes señalaron la causa hereditaria como parte sustancial de las enfermedades mentales dada la observación clínica de la alta agregación familiar [29]. Sin embargo, no es hasta los estudios de Kallman y Slater a mediados del siglo XX, que se obtuvo resultados fehacientes de la importancia de la herencia en la etiología de las enfermedades mentales severas, tales como la esquizofrenia y el trastorno afectivo bipolar [30]. Estas conclusiones fueron observadas hace más de 50 años y han sido refrendadas por diseños actuales que cuentan con una mayor cantidad de datos y con métodos de análisis estadístico y de laboratorio más sofisticados. En el Cuadro 2 se señalan algunos de los principales diseños de investigación en genética.
Estudios de agregación familiar [31], estudios de gemelos [32] y estudios de adopción [33]. Los estudios de gemelos, ya sean gemelos monocigóticos o gemelos idénticos (hermanos provenientes de la división de un cigoto), o gemelos dicigóticos o mellizos (hermanos debido a la existencia de dos cigotos distintos), corresponden a un “experimento genético natural”, puesto que permiten diferenciar la contribución genética de la ambiental sobre un fenotipo, al asumir que los hermanos presentan un contexto similar. Estos estudios estiman la concordancia, que se expresa como la proporción de mellizos que comparten un rasgo en una muestra de mellizos [34].
Estudios de segregación. Este tipo de análisis corresponden a un método estadístico que permite determinar el patrón de transmisión de un rasgo, ya sea monogénico (mendeliano) o poligénico. Asimismo, existen análisis de segregación complejos que permiten estudiar el patrón de herencia incorporando una mayor cantidad de variables [35].
Estudios de ligamiento [36]. Esta clase de estudios permiten establecer asociaciones de manera indirecta, ya que se establece un gen candidato y se identifican algunos polimorfismos situados en este gen a modo de marcadores genéticos, a razón de establecer un haplotipo vinculado a la patología. De esta manera, estos polimorfismos genéticos, sin importancia funcional, se asociarían a la enfermedad “indirectamente” por encontrarse en desequilibrio de ligamiento con la variante causal [34].
Estudios de asociación con genes candidatos y estudios de asociación por barrido genómico (
Fuente: elaborado por los autores.
La investigación genética en psiquiatría agrupa aquellos estudios que buscan demostrar la existencia de la herencia en la etiopatogenia de los trastornos psiquiátricos; los que analizan modelos de herencia y aquellos que tratan de establecer mecanismos de acción genéticos de los síntomas y los trastornos mentales (Cuadro 2). La evidencia demuestra que el grado de contribución de las variantes genéticas es dinámico y considerable para los diferentes trastornos psiquiátricos [39]. Así por ejemplo, algunos estudios en gemelos revelan una heredabilidad del 80% para esquizofrenia [42] y trastorno afectivo bipolar [43], y de alrededor de 50% para el trastorno depresivo mayor [44].
Existen trastornos en psiquiatría que son total o casi totalmente determinados por una variante genética, que en general son enfermedades infrecuentes. Por otro lado, otro grupo de enfermedades están causadas por una combinación del efecto de muchas variantes genéticas, cada una de efecto pequeño, que interactúan entre sí y con factores ambientales. Es decir, los trastornos psiquiátricos presentan diferentes patrones de combinación de factores causales o “arquitecturas” genéticas [45]. Prácticamente, todos tienen una heredabilidad de moderada a alta [2], lo que quiere decir que la proporción de la variación en la población que se explica por factores genéticos supera el 50% [2]. No obstante, la alta heredabilidad no implica necesariamente que las asociaciones genéticas sean fáciles de detectar [45].
Estos antecedentes y hallazgos propiciaron la creación de la International Society of Psychiatric Genetics y el Psychiatric Genomics Consortium, que ha permitido aunar datos genéticos de miles de personas a nivel mundial [46]. En Latinoamérica, la investigación genética en psiquiatría es incipiente. Si bien su población representa aproximadamente al 8,4% del total mundial, entre los participantes en estudios de asociación por barrido genómico hay solamente un 1,3% de individuos de origen hispánico [47]. Pese a ello, existen proyectos y consorcios que han avanzado en este objetivo. Uno de ellos es el Proyecto Paisa, que cuenta con más de 9000 participantes de la población paisa en Colombia [48], caracterizada por presentar una menor variación genética, dado el aislamiento geográfico y expansión demográfica de algunas de sus regiones [49]. El proyecto pretende evaluar la relación entre los fenotipos de las enfermedades mentales graves y las variantes genéticas que pudieran contribuir al riesgo de presentarlas. Sumado a ello, desde 2021 se desarrolla en Colombia “Misión Origen” [50]. Se trata de un proyecto liderado por la Universidad de Antioquía y el National Institute of Mental Health de Estados Unidos, que pretende convertirse en uno de los estudios genéticos en enfermedades mentales severas más grandes del mundo, reclutando a cerca de 100 000 participantes, la mitad de ellos con algún diagnóstico psiquiátrico y el resto de los participantes sin diagnósticos del área. Finalmente, desde 2017 existe la Red Latinoamericana para el Estudio de la Psicosis Temprana (Latin American Network for the Study of Early Psychosis studies, ANDES), consorcio que incluye 15 grupos de seis países, entre ellos Chile. Esta red busca generar colaboraciones de investigación genética dentro de la región, permitiendo la transferencia de conocimientos entre grupos con énfasis en aspectos específicos de la psicosis [51].
Bases de datos genéticas-genómicas
La creación de bases de datos genéticas nace a partir de la sobrecarga de información y el reconocimiento de la promesa científica de conocimiento que se obtendría de ellas. La difusión de las nuevas técnicas para secuenciar el ADN y las proteínas, así como el volumen cada vez mayor de secuencias almacenadas en los bancos de datos, hicieron necesaria la creación de algoritmos para catalogar y comparar secuencias, en los que se reconoce como pionera a Margaret Oakley Dayhoff, quien publicó en 1965 el Atlas of Protein Sequence and Structure, que contenía la secuencia de 65 proteínas [52]. En 1980, creó la primera base de datos computarizada con secuencias de ácidos nucleicos y proteínas [53]. Paralelamente, se gestaron bases de datos primarias como GenBank, creada en 1982 con el fin de almacenar todas las secuencias de ADN disponible [28]. Su crecimiento ha sido exponencial, de 70 mil pares de bases de secuencias de ADN a finales de 1982, a más de un billón de pares de bases en octubre de 2022, duplicándose cada 18 meses [54]. Pertenece al National Center for Biotechnology Information (NCBI) de la National Library of Medicine de Estados Unidos. Actualmente, es parte de la colaboración Internacional de Bases de Datos de Secuencias de Nucleótidos que se integra por el Banco de Datos de ADN de Japón y el Archivo Europeo de Nucleótidos [54].
Hoy en día existen bases de datos que incluyen secuencias de nucleótidos, proteínas, genomas, factores de transcripción, entre otros. A continuación, se describen algunas bases de datos de utilidad en la práctica clínica.
Base de datos sobre genes humanos y trastornos genéticos. Fue creada en 1960 como un catálogo de rasgos y trastornos mendelianos, que se titula Mendelian Inheritance in Man (MIM). La versión en línea fue creada en 1985 y desde 1995 está disponible en el National Center for Biotechnology Information (
Una herramienta de interés para la práctica clínica es la vinculación de sinopsis clínicas asociadas a fenotipos, las que se encuentran disponibles en la sección “relación gen y fenotipo”. Permite comparar las características clínicas de múltiples fenotipos que se basan en el aspecto molecular de los trastornos. Esto facilita la elaboración de pronósticos y/o tratamientos particulares para los pacientes.
ClinVar
Se crea en 2012 por el National Center for Biotechnology Information con el fin de obtener interpretaciones clínicas relevantes de variaciones genéticas humanas [56]. ClinVar incluye mayoritariamente variantes de nucleótido único, inserciones o deleciones cortas y también más de 16 000 variaciones de tipo estructural [57]. La búsqueda en ClinVar se realiza en el conjunto de bases de datos del National Center for Biotechnology Information (
El contenido de ClinVar contempla detalles de la variante, remitente (quien ingresa el registro a ClinVar), gen o genes afectados por la variante, enfermedad o condición asociada y su interpretación, estado de revisión y la evidencia. Además, se anexan enlaces de otras bases de datos como ClinGen, GeneReviews, Genetic Testing Registry, MedGen, Online Mendelian Inheritance in Man y Variation.
Ensembl
Navegador de genomas desarrollado en 1999 por el Instituto Europeo de Bioinformática (EMBL-EBI) y el instituto Wellcome Trust Sanger [58], con el fin de brindar una anotación automática del genoma e integrar estas anotaciones con otros datos biológicos disponibles. Es de utilidad si se necesita información sobre variaciones de la secuencia de un gen que se asocia a una enfermedad o condición, búsqueda de genes homólogos en otras especies, explorar la región alrededor de un gen de interés, búsqueda de secuencias asociadas a la regulación de genes, entre otros. Desde 2009 existe el proyecto Ensembl Genomes para proporcionar datos de referencia taxonómicos y así entregar un contexto evolutivo para brindar un mejor entendimiento de los genes. Incluye genomas de plantas, hongos, metazoos, bacterias y protistas.
El acceso es desde su página web (
Ensembl presenta diversas herramientas de interés como el buscador BLAT/BLAST. Este permite la búsqueda mediante la secuencia de un gen o proteína; el predictor de efecto de variantes, que analiza variantes y puede predecir sus consecuencias funcionales y Biomart, lo que permite exportar conjuntos de datos personalizados.
Es una base de datos de polimorfismos de nucleótido único creada por el National Center for Biotechnology Information en colaboración con el Instituto Nacional de Investigación del Genoma Humano en 1999 [59]. Incluye otras variaciones, como pequeñas inserciones/eliminaciones y microsatélites o repeticiones cortas en tándem [60].
La búsqueda en The Single Nucleotide Polymorphism Database puede realizarse directamente desde su página web (
Viñeta clínica
A continuación, esbozamos una viñeta clínica a partir del caso ficticio de un paciente de 13 años que consulta por síntomas mentales (Cuadro 3). Para su manejo, se decidió la realización de estudios genéticos.
Consulta un paciente de sexo masculino de 13 años de edad, con antecedente de coeficiente intelectual normal bajo según una psicometría precedente y trastorno por déficit de atención. Presenta el antecedente familiar de padre con trastorno afectivo bipolar diagnosticado a los 25 años de edad. La madre menciona que hace tres meses nota un cambio notorio. Su hijo ha perdido el interés por ir al colegio, juntarse con sus amigos y hacer cosas que antes le gustaban. Comenta que disfrutaba jugar fútbol, pero ya no demuestra emoción por asistir a sus partidos. Indica que lo nota aislado y más serio, por lo que teme que pueda estar pasando por una depresión. Le preocupa que ya no es solo ella quien lo nota, sino que la profesora de su hijo le comenta que en el colegio ha comenzado a sufrir
Luego de una búsqueda en
En esta viñeta se muestra cómo se puede avanzar en la comprensión de la etiología de un trastorno mental, utilizando algunas herramientas disponibles.
Fuente: elaborado por los autores.
Conclusiones
En esta revisión se abordaron conceptos, hallazgos y algunas herramientas que pueden ser utilizadas para aplicar los conocimientos de genética en psiquiatría. Si bien su desarrollo ha tenido un avance lento, se posiciona como un área de relevancia dado sus hallazgos en el entendimiento y posible manejo y prevención de los trastornos psiquiátricos.
Existe una gran cantidad de evidencia sobre las bases genéticas de los trastornos psiquiátricos, así como tecnologías sofisticadas para acceder a grandes cantidades de información genética de los individuos a costos que hacen factibles la comparación de decena de miles de individuos. Sin embargo, la herramienta más básica de la medicina genómica y que tiene aplicación universal, es la historia familiar, un elemento que los clínicos siempre deben considerar. Algunos casos seleccionados por criterios como una presentación atípica en relación con la edad de inicio o con las manifestaciones clínicas, o por la presencia de antecedentes familiares, requerirán el uso de ciertos estudios específicos. A la revisión de estos estudios dedicaremos un artículo complementario a este.
El presente artículo recapituló los conceptos centrales para comprender cómo la variación genética puede tener un efecto sobre el riesgo de presentar una enfermedad psiquiátrica.
Esperamos contribuir a la comprensión de la relevancia de realizar investigación genética en Chile, crucial para evitar la extrapolación de resultados en poblaciones cuyo origen ancestral es diferente. Con ello, se busca apuntar a que las personas con trastornos psiquiátricos puedan acceder a una medicina de precisión.

