Artículo de revisión
← vista completaPublicado el 8 de abril de 2025 | http://doi.org/10.5867/medwave.2025.03.2938
Colonización oral y orofaríngea por Enterobacteriaceae: revisión narrativa sobre su epidemiología e impacto clínico
Oral and oropharyngeal colonization by Enterobacteriaceae: A narrative review on its epidemiology and clinical impact
Resumen
La familia abarca un amplio grupo de bacterias gramnegativas del orden enterobacterales, residentes habituales de los tractos intestinal y urinario, comportándose solo como alóctonos en cavidad oral. No existe un consenso respecto a prevalencias, determinantes y consecuencias de la colonización aero-digestiva alta por esta familia de bacterias. Ante esto, se realizó una revisión narrativa sobre la epidemiología e impacto clínico que tendría la colonización oral y orofaríngea de , diferenciando por grupos etarios. Se ejecutó una búsqueda bibliográfica organizada en cuatro bases de datos digitales: PubMed/MEDLINE, SciELO, Google Scholar y Cochrane Library de estudios clínicos y preclínicos publicados en los últimos veinte años (2003 a 2023). El tema buscado fue la colonización asintomática de en tracto aerodigestivo alto, sus determinantes e impacto clínico. La colonización oral y orofaríngea por fue de 38,24 y 39% en promedio, respectivamente. Los géneros spp. (68,75%), spp. (68,75%), spp. (43,75%), spp. (25%), spp. (25%) fueron los grupos taxonómicos más prevalentes en cavidad oral, especialmente en infanto-adolescentes, mientras que spp. (22,5%), spp. (15,5%) y spp. (8%), lo fueron en la zona orofaríngea de sujetos seniles mayoritariamente. Esta colonización demuestra la vinculación de un riesgo aumentado de episodios infecciosos e inflamatorios como neumonía, enfermedad inflamatoria intestinal, enfermedad periodontal y progresión de insuficiencia renal, con determinantes que difieren en función de la edad. En este contexto, la enfermedad periodontal es un factor de riesgo compartido para grupos seniles y no seniles. La presencia de enterobacterias en tracto aerodigestivo alto es significativa, dominando en infanto-adolescentes. Esta presencia es promovida por diversos factores que difieren según la edad y con consecuencias sistémicas de naturaleza infecciosa o inflamatoria en ciertos tipos de hospedadores. Aún no es posible precisar su rol en la patogénesis de enfermedades orales como la periodontitis.
Ideas clave
- Al momento de la elaboración de este trabajo, no existen revisiones de literatura que resuman la evidencia disponible referente a los determinantes e impacto clínico local y sistémico, que podría tener la colonización oral y orofaríngea asintomática de Enterobacteriaceae.
- Este trabajo resume y analiza la evidencia disponible acerca de las consecuencias, prevalencia y determinantes de colonización de este grupo de bacterias gramnegativas en un nicho no habitual para ellas, como es la boca y la orofaringe, discriminando entre grupos seniles y no seniles.
Introducción
La familia Enterobacteriaceae abarca un amplio grupo de bacterias gramnegativas del orden Enterobacterales, conformado por más de 30 géneros y más de 100 especies con gran impacto médico, veterinario y de salud pública. En el humano se comportan como residentes habituales de los tractos intestinal y urinario; asociadas a un amplio rango de síndromes clínicos como enteritis alimentaria e infecciones zoonóticas [1]. Según el Communicable Disease Center (CDC), géneros de la familia Enterobacteriaceae figuran como patógenos importantes para tres de las cuatro categorías principales de infecciones vinculadas con la atención en salud, causando entre el 23 y el 31% de estas en las salas de adultos, pediátricas y oncológicas [2,3]. Adicionalmente, según la Organización Mundial de la Salud (OMS) las Enterobacteriaceae resistentes a carbapenemes y cefalosporinas de tercera generación se encuentran en el tercer lugar de los diez patógenos prioritarios. Para estas bacterias son necesarios antibióticos nuevos, de tal forma de cubrir su extensa resistencia [4].
Las enterobacterias se comportan como alóctonos en cavidad bucal. Su presencia solo llega a ser significativa y persistente en condiciones inflamatorias locales que promueven su expansión clonal [5,6], o ante estados sistémicos que impactan en la ecología oral como la inmunosupresión asociada a envejecimiento [7]. También puede llegar a serlo en cuadros respiratorios recurrentes en población adolescente [8]. Se ha reportado que un microbioma con sobreabundancia de enterobacterias y sus productos, genera inflamación crónica con aumento de permeabilidad epitelial. Ello favorece la translocación de estas bacterias y sus metabolitos hacia otros órganos vía hematógena y entérica. Esta condición se ha relacionado con riesgo aumentado de enfermedades no comunicables como enfermedad renal crónica [9], diabetes mellitus [10], hígado graso [11], enfermedad respiratoria [12] cardiaca [13], neuronal [14], enfermedad inflamatoria de Bowel [15], obesidad [16] y cáncer [17]. Esta asociación estaría fundamentada en la teoría de los órganos germinales [18].
Sobre la base de estudios provenientes principalmente de Brasil, Estados Unidos, Reino Unido, Alemania, Australia, la India y Malasia, la prevalencia oral de Enterobacteriaceae varía ampliamente según región geográfica, grupo etario, estatus racial, portación de prótesis o aparatología, hábitos parafuncionales, estado médico, estatus periodontal y metodologías empleadas, pudiendo oscilar entre 0 y 72% [19,20,21,22,23,24,25,26,27,28,29,30,31,32]. Este grupo de bacterias de morfología bacilar, anaerobias facultativas y gramnegativas se constituye en las más frecuentemente recuperadas de cavidad bucal. Esto es especialmente notorio en adultos mayores de 50 años, asiáticos, portadores de prótesis o aparatología dental y con comorbilidades como la enfermedad renal crónica. Las especies Raoultella ornithinolytica, Enterobacter cloacae , Klebsiella pneumoniae subespecie pneumoniae y Klebsiella oxytoca, son las más comúnmente aisladas [26,27]. En efecto, se ha demostrado que la microbiota oral bajo disbiosis contiene la abundancia relativamente más alta de Enterobacteriaceae comparado con otros sitios mucosos [33]. El objetivo de este trabajo es aportar una revisión actualizada que resuma toda la evidencia publicada en los últimos veinte años sobre la colonización asintomática de Enterobacteriaceae en el tracto aerodigestivo alto, junto con sus determinantes e impacto clínico, diferenciando por población senil (mayores de 65 años) y no senil (menores de 65 años). Todo ello, fundado en los antecedentes antes descritos, y dada la falta de revisiones de literatura que resuman la evidencia disponible referente a los determinantes e impacto clínico local y sistémico que podría tener la colonización oral y orofaríngea asintomática de Enterobacteriaceae.
Métodos
Se llevó a cabo una revisión comprensiva de la literatura científica relevante publicada en los últimos veinte años (desde 2003 a 2023), en idiomas inglés y español y en texto completo; relativa a la epidemiología e impacto clínico que tendría la portación oral y orofaríngea de bacilos gramnegativos pertenecientes a la familia Enterobacteriaceae. Para ello se ejecutó una búsqueda organizada en cuatro bases de datos digitales: PubMed/Medline, SciELO, Google Scholar y Cochrane Library. Se utilizaron los siguientes términos MeSH y combinaciones de búsqueda: Enterobacteriaceae AND oral colonization OR oropharyngeal colonization AND risk factors AND clinical importance OR medical importance.
Los criterios de inclusión para esta revisión fueron:
-
Estudios preclínicos en modelos animales.
-
Estudios clínicos observacionales, descriptivos o analíticos.
-
Revisiones sistemáticas con o sin metaanálisis de estudios descriptivos transversales o analíticos de casos-controles y cohortes.
Los criterios de exclusión fueron:
-
Estudios clínicos experimentales.
-
Cartas al editor.
-
Revisiones narrativas.
-
Revisiones sistemáticas con o sin metaanálisis de ensayos clínicos.
Se empleó el programa Microsoft Excel 2019 para organizar y procesar la evidencia seleccionada, la cual se analizó bajo el modelo de razonamiento deductivo. Se aplicó estadística descriptiva para resumir los datos de frecuencias y llegar a un consenso respecto a las tasas de colonización oral y orofaríngea informadas en los distintos estudios primarios recolectados.
Resultados
Basándonos en los criterios de inclusión empleados, 18 estudios fueron seleccionados para cumplir el objetivo de la presente revisión. De ellos, 15 fueron estudios clínicos (6 con diseño caso-control y 9 estudios descriptivos de corte transversal), y 3 preclínicos, ejecutados en modelos animales.
Respecto a los estudios clínicos, 13 de ellos estudiaron la tasa de colonización oral de Enterobacteriaceae. Solo dos estudios evaluaron la presencia de este grupo de bacterias en orofaringe; en los cuales participaron un total de 18 794 sujetos, con 65,04% de participación femenina y 34,96% de participación masculina, con edades comprendidas entre los 6 y 101 años. Siete de estos estudios utilizaron saliva para la búsqueda de enterobacterias en cavidad bucal, cinco emplearon muestra de biopelícula recuperada a partir de bolsa periodontal o dorso de lengua, y un estudio empleó biopelícula acumulada en retenedores. Solo dos de los estudios clínicos seleccionados utilizaron hisopado de orofaringe para investigar la presencia de este grupo de bacterias. Sobre el método de identificación microbiana, 12 de los 15 estudios clínicos seleccionados usaron sistemas de identificación fenotípica (Tabla 1), 2 emplearon espectrometría de masa (Matrix-Assisted Laser Desorption/Ionization-Time-Of-Flight/) MALDI-TOF combinada o no con métodos fenotípicos como Vitek 2 y moleculares como la secuenciación de ADN ribosomal 16S (Tabla 1), y un estudio empleó, únicamente, método molecular basado en hibridación de ADN.
Epidemiología
Colonización oral de Enterobacteriaceae: la tasa de portación de Enterobacteriaceae en sitios orales, independientemente de los factores de exposición y variables demográficas, fue de 38,24% en promedio (Tabla 1). Adicionalmente, la revisión de artículos seleccionados permitió establecer el protagonismo de los nichos subgingivales como reservorio de patógenos oportunistas, entre ellos las enterobacterias. En efecto, tres estudios latinoamericanos y uno europeo, reportan en promedio una tasa de 29,25% de colonización de Enterobacteriaceae en biofilm subgingival de sujetos sistémicamente sanos con diferentes grados de enfermedad periodontal [30,40,41,42].
Considerando la edad de los sujetos participantes, solo diez estudios especificaron esta información. En cinco de ellos, las muestras se obtuvieron de personas infanto-adolescentes, cuyas edades oscilaban entre 6 y 17 años, cuatro estudios evaluaron la colonización oral de enterobacterias en personas adultas jóvenes y de mediana edad, y un solo estudio evaluó la colonización en un amplio rango etario, desde niños hasta adultos mayores (Tabla 1). La prevalencia de colonización por Enterobacteriaceae en el grupo de infanto-adolescentes resultó de 53,72% frente a 39,13% para personas adultas y mediana edad.
Desde el punto de vista taxonómico, los géneros bacterianos identificados en el total de estudios incluidos en el análisis fueron Enterobacter spp., Klebsiella spp., Raoultella spp., Citrobacter spp., Serratia spp., Escherichia spp., Pantoea spp., Proteus spp., Rahnella sp., Shigella spp., Yersinia spp. De estos, los géneros Enterobacter spp. (68,75%), Klebsiella spp. (68,75%), Escherichia spp., (43,75%), Citrobacter spp., (25%) y Pantoea spp., (25%) fueron los grupos taxonómicos más prevalentes en cavidad oral del total de sujetos evaluados. Adicionalmente, los géneros Enterobacter spp., Klebsiella spp., Citrobacter spp., y Pantoea spp. fueron aquellos que tuvieron mayor representación de especies colonizando cavidad oral (Figura 1). La especie Enterobacter cloacae fue identificada en el 75% de los estudios evaluados, mientras que las especies Klebsiella pneumoniae, Escherichia coli y Enterobacter aerogenes demostraron la misma prevalencia, ya que aparecieron en el 40% de los estudios evaluados, seguido de Enterobacter gergoviae, la cual se informó en el 30% de los estudios analizados. Si consideramos la taxonomía de Enterobacteriaceae en la biopelícula subgingival, los estudios analizados demuestran que los géneros Enterobacter, Serratia y Klebsiella son los grupos dominantes en surco y bolsa periodontal. A nivel de especie, Enterobacter cloacae, Serratia marcescens y Klebsiella oxytoca muestran las mayores tasas de prevalencia a nivel de sitios periodontales, tanto en salud como en enfermedad [30,40,41,42].
Prevalencia, determinantes y efectos de la colonización asintomática de
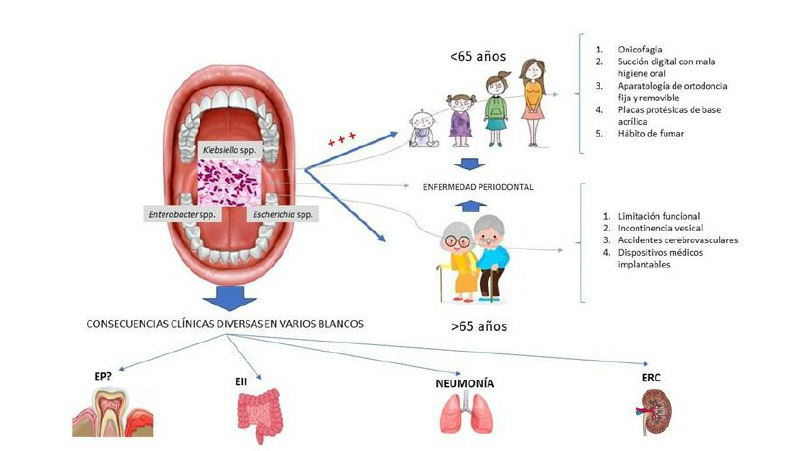
Nota: sobre la base de la revisión realizada, los géneros
Fuente: elaborada por los autores con el programa Microsoft Power Point 2019.
Respecto del fenotipo, solo 7 estudios de los 10 seleccionados para este acápite evaluaron la actividad antimicrobiana. Sobre esto, las drogas menos activas frente a este grupo de bacterias fueron amoxicilina (85% de aislados resistentes), seguida de ampicilina (71% de aislados resistentes), amoxicilina más ácido clavulánico (42,8% de aislados resistentes), ciprofloxacina (35% de aislados resistentes), y trimetoprima sulfametoxazol (24% de aislados resistentes).
Sobre la base del análisis de las investigaciones que estudiaron la susceptibilidad antimicrobiana en aislados de enterobacterias derivadas exclusivamente de nichos subgingivales, se obtuvo que las especies de Serratia spp., Enterobacter spp., y Klebsiella spp., exponen frecuentemente resistencia intrínseca a betalactámicos de administración rutinaria como ampicilina, amoxicilina, amoxi-clavulánico y cefalosporinas de primera y segunda generación [30,40,41].
Colonización orofaríngea de Enterobacteriaceae: la tasa de portación de Enterobacteriaceae en la orofaringe, independientemente de los factores de exposición y variables demográficas, fue del 39% en promedio (Tabla 1). Tomando en cuenta la edad de los sujetos participantes, solo dos estudios especificaron esta información. En los mismos, las muestras se obtuvieron a partir de personas de edad avanzada, cuyas edades oscilaron entre los 55 y 101 años en el primer estudio. En el segundo estudio, todos los participantes fueron mayores de 65 años. La prevalencia de colonización orofaríngea por Enterobacteriaceae en el primer grupo fue del 38% frente al 40% para el segundo grupo (mayores de 65 años, Tabla 1).
Desde el punto de vista taxonómico, los géneros bacterianos que se identificaron en el total de estudios incluidos en el análisis fueron Enterobacter spp., Klebsiella spp., Escherichia spp., Raoultella spp., Proteus spp., Rahnella spp. De estos, los géneros Klebsiella spp. (22,5%), Escherichia spp. (15,5%) y Enterobacter spp. (8%), fueron los grupos taxonómicos más prevalentes en la zona orofaríngea del total de sujetos evaluados. Adicionalmente, estos géneros fueron aquellos que tuvieron mayor representación de especies en este nicho ecológico (Tabla 1). Las especies Klebsiella pneumoniae, Escherichia coli y Enterobacter aerogenes fueron identificadas en el 100% de los estudios incluidos, mientras que las especies Proteus mirabilis, Raoultella planticola y Rahnella sp., solo aparecieron en el 50% de los estudios evaluados.
Respecto del fenotipo solo un estudio, de los dos seleccionados para este acápite, evaluó la actividad antimicrobiana. Sobre esto, solo Escherichia coli mostró fenotipo multidrogoresistente, siendo las ampicilinas, piperacilinas, cefazolina, ceftazidima, cefotaxima, cefozopran, cefpodoxima y ciprofloxacina las drogas menos activas frente a aislados de esta especie. Cepas de Klebsiella pneumoniae mostraron resistencia únicamente a la ampicilina; Serratia marcescens fue resistente a la ampicilina y cefazolina, mientras que Enterobacter cloacae mostró resistencia a la ampicilina, cefazolina, ceftazidima, cefotaxima, cefpodoxima, y fosfomicina. Los antibióticos menos activos contra Klebsiella aerogenes fueron las ampicilinas, cefazolina, ceftazidima y cefotaxima. Finalmente Morganella morganii demostró resistencia a la ampicilina, cefazolina, cefpodoxima y fosfomicina. Solamente aislados de Rahnella sp y Raoultella planticola mostraron sensibilidad a todos los antibióticos testeados [36]. Por el contrario, en el estudio referenciado los antibióticos que demostraron alto desempeño contra aislados de enterobacterias derivadas de orofaringe, fueron carbapenémicos, piperacilina tazobactam, ampi-sulbactam, amikacina y sulfametoxazol [36].
Determinantes de colonización
El análisis de los estudios incluidos en la revisión permitió detectar como determinantes asociados a la portación asintomática de esta familia de bacterias en boca y orofaringe, considerando la edad de los pacientes, las limitaciones funcionales debido a enfermedades neoplásicas, respiratorias y cardiacas, deterioro o estado clínico terminal, incontinencia vesical, accidentes cerebrovasculares (infarto cerebral o hemorragia cerebral) y sondas de gastrostomía endoscópica percutánea en sujetos mayores de 65 años [35,36] (Figura 1). En menores de 65 años se reconocieron como determinantes de colonización oral y orofaríngea la onicofagia, el uso de aparatos de ortodoncia (fija y removible), placas protésicas de base acrílica, succión digital acompañado de un alto índice de placa dental y hábito de fumar. Las bolsas periodontales son un factor determinante en ambos grupos de edad [27,28,30,32,38,39,42] (Figura 1). Respecto a este último determinante, la evidencia vinculada y recogida desde 2007 hasta 2022, concuerdan en la relevancia médica del biofilm subgingival como un reservorio de patógenos oportunistas del grupo de bacilos gramnegativos, entre ellos Pseudomona aeruginosa, Acinetobacter spp., y enterobacterias [40,42].
Excluyendo el factor edad, la enfermedad renal crónica severa asociada a diálisis peritoneal, ha sido también reconocida como promotora para la colonización y proliferación oral y orofaríngea de enterobacterias. Ello, sustentado en la acumulación de toxinas urémicas que alteran el medio bucal, y que a su vez ejercen una presión selectiva sobre el microbioma oral. Todo esto lleva a su disbiosis, con una prevalencia significativamente mayor de enterobacterias productoras de ureasa. Esta disbiosis oral puede conducir potencialmente a un aumento de episodios infecciosos e inflamatorios resistentes, que pueden contribuir hacia la progresión de la enfermedad renal y su tasa de mortalidad [26,34].
Importancia médico-odontológica
Sobre la base de la evidencia revisada, los riesgos médico-odontológicos que se reconocieron vinculados a la colonización asintomática de enterobacterias fueron:
Neumonía en pacientes con ventilación mecánica o con broncoaspiración: en efecto, la presencia de bacterias resistentes a los antimicrobianos en el área orofaríngea, plantea un riesgo potencial de infecciones pulmonares como neumonía por aspiración en residentes de centros de atención a largo plazo [34]. Adicionalmente, la evidencia demuestra que la colonización oral por Klebsiella pneumoniae asocia un riesgo de neumonía por aspiración en individuos susceptibles [38] (Figura 1).
Enfermedad inflamatoria intestinal: las especies de Enterobacteriaceae como Klebsiella pneumonie y Escherichia coli han sido vinculadas a la patogénesis de la enfermedad inflamatoria de Bowel o enfermedad inflamatoria intestinal [43]. Paralelo a esto, y con respecto al tema planteado en esta revisión, en el año 2017 una investigación preclínica liderada por Honda Kenya demostró que la translocación intestinal de cepas orales de Klebsiella spp., (procedentes de la saliva de sujetos sanos y con enfermedad inflamatoria intestinal/enfermedad de Crohn y colitis ulcerativa) en animales gnotobióticos, producía una diferenciación inmune polarizada a un fenotipo Th1 en la lámina propia colónica de los ratones. Adicionalmente, los investigadores determinaron que las cepas orales de Klebsiella eran resistentes a múltiples antibióticos y solo podían mediar una colonización eficiente en animales con disbiosis intestinal, generada por tratamiento antibiótico previo. Sin embargo, esta polarización inmune a fenotipo Th1, solo se tradujo en una respuesta inflamatoria en los ratones Il10-/-, o genéticamente propensos a colitis [37] (Figura 1).
La estructura de búsqueda empleada en esta revisión, permitió obtener una segunda evidencia preclínica que demostró la capacidad de aislados de Enterobacteriaceae (Escherichia coli, Salmonella Enteritidis LB y Salmonella Typhimurium) de generar inflamación gastrointestinal temprana, tras ser inoculados oralmente en aves en el día de su eclosión [44].
La tercera evidencia preclínica obtenida y analizada en esta revisión demostró por modelo murino de periodontitis inducida por ligadura, la expansión de patobiontes orales pertenecientes a la familia Enterobacteriaceae. Dicha situación patrocinó la inflamación intestinal en ratones con colitis inducida por dextrano-sulfato de sodio (DSS). Específicamente, el estudio demostró que la inflamación oral promovió la proliferación de Enterobacteriaceae incluyendo Klebsiella spp., y Enterobacter spp. Ello impuso la colonización de estos patobiontes en el intestino de ratones genéticamente susceptibles (interleucina-10-/-), exacerbando la inflamación intestinal preexistente. No obstante, dicha colonización no fue posible en ratones B6 wild type o inmunocompetentes. Adicionalmente, el estudio demostró que la colonización intestinal directa por estos patobiontes orales inducía una fuerte producción de interleucina-1B vía activación del inflamosoma en macrófagos del intestino inflamado, agravando de esta forma la patología intestinal. Sin embargo, la sobre colonización por estos patobiontes orales no fue posible en ratones con intestino saludable, aún en presencia de periodontitis. Ante estos hallazgos, los investigadores sugirieron que se requieren, al menos, dos eventos microbianos para que se produzca la inflamación intestinal conducida por patobiontes orales:
-
Disbiosis oral como primer prerrequisito, situación que aumentaría el número de patobiontes en la cavidad oral.
-
Disbiosis intestinal con disminución de la resistencia a la colonización de patobiontes orales que pasarían a este hábitat vía barrera gástrica.
Es importante recalcar que las cepas de Klebsiella que obtuvieron los investigadores de este estudio, a partir de ratones con periodontitis, se corresponden con cepas resistentes a antibióticos. Ante esto, los autores sugirieron el riesgo potencial que tiene el uso de antibióticos para mediar inflamación intestinal favoreciendo la colonización ectópica de patobiontes orales en el entorno intestinal disbiótico [45].
Empeoramiento del estado sistémico de pacientes con insuficiencia renal crónica: en función de los resultados obtenidos por Costa et al [26], en un estudio observacional de casos-controles publicado recientemente, la mayor prevalencia y diversidad de especies de enterobacterias clínicamente relevantes en la cavidad oral de pacientes con enfermedad renal crónica bajo diálisis peritoneal, supone un mayor riesgo de infecciones y episodios inflamatorios, contribuyendo a la progresión de la enfermedad renal y a su tasa de mortalidad. Esto, debido a niveles de colonización significativamente más altos para la especie Raoultella ornithinolytica en saliva de pacientes renales respecto de los controles, favorecido por el incremento salival significativo del pH, urea y amonio en el grupo de casos. Además, el estudio demostró la existencia de resistencia a multidrogas, exclusivamente en los aislados derivados de los pacientes con enfermedad renal. Ello implica un mayor riesgo de infecciones mórbidas severas en este grupo de pacientes, contribuyendo a un aumento en la tasa de mortalidad (Figura 1).
Posible rol patogénico en la enfermedad periodontal: en efecto, un estudio muy importante publicado en el año 2016 por Vieira Colombo et al [42], determinó la prevalencia y niveles de especies patogénicas de relevancia médica en la microbiota subgingival de individuos con distinto estatus periodontal. Con ello se demostró que las especies bacterianas más relacionadas con la inflamación periodontal y la destrucción tisular, tanto a nivel de sitio como de paciente, fueron Neisseria spp., Pseudomonas aeruginosa, Olsenella uli, Hafnia alvei, Filifactor alocis, y enterobacterias como Serratia marcescens. En adición a esta evidencia, Pontes et al, [40] quienes estudiaron la prevalencia y susceptibilidad antimicrobiana de bacilos gramnegativos en sitios periodontales patológicos, pudieron concluir en función de sus observaciones, una alta prevalencia y diversidad de bacilos gramnegativos con baja sensibilidad a betalactámicos, integrando la microbiota subgingival asociada con periodontitis (Figura 1).
Discusión
Enterobacteriaceae es una familia que abarca varias especies bacterianas de amplia importancia clínica, ya que muchas de ellas exhiben altos niveles de resistencia a los antimicrobianos, la cual puede ser mediada por mecanismos enzimáticos y no enzimáticos. Dichos mecanismos están codificados en genes intrínsecos o son adquiridos por elementos genéticos móviles [46]. Los Enterobacteriaceae resistentes a cefalosporinas de tercera generación y a carbapenemes son clasificados por la OMS como patógenos prioritarios [47]. El mecanismo de resistencia a antibióticos de mayor impacto clínico y terapéutico, es para muchas bacterias gramnegativas como Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Pseudomona aeruginosa, Proteus mirabilis, Enterobacter cloacae y Aeromonas spp, la producción de enzimas del tipo β-lactamasas (β-lactamasas de espectro extendido y carbapenemasas) que hidrolizan el anillo β-lactámico de un amplio grupo de antimicrobianos, desde penicilinas, cefalosporinas de primera, segunda y tercera generación, hasta monobactámicos y carbapenemes. En función del tipo de enzima expresada, esta resistencia puede extenderse a inhibidores suicidas como ácido clavulánico, sulbactam y tazobactam, incluso puede abarcar a otras clases de antibióticos como trimetoprima sulfametoxazol, quinolonas y aminoglucósidos [46,48].
Desde el punto de vista morfológico, estructural y fisiológico, las Enterobacteriaceae se corresponden con bacilos gramnegativos, anaerobios facultativos, no formadores de esporas. En su mayoría son habitantes normales del tracto intestinal de humano y animal. Las infecciones causadas por estas bacterias, resultan frecuentemente de la translocación desde un nicho habitual a otro no habitual [19]. Adicionalmente, las infecciones causadas por cepas productoras de β-lactamasas de espectro extendido o de carbapenemasas, se asocian con un aumento en las tasas de mortalidad, tiempo prolongado hasta una terapia efectiva, larga estancia hospitalaria y elevados costos sanitarios [49,50]. Paralelo a esto, se ha establecido que la microbiota oral bajo disbiosis contiene la abundancia relativa más alta de Enterobacteriaceae, comparada con otros sitios mucosos [51]. De acuerdo a estos datos, consideramos relevante resumir y analizar la evidencia disponible acerca de las consecuencias, prevalencia y determinantes de colonización de este grupo de bacterias gramnegativas en un nicho no habitual para ellas, como es la boca y la orofaringe, discriminando entre grupos seniles y no seniles. Esto con el fin de reconocer grupos de riesgo para la portación, y potencialmente para el desarrollo de infecciones oportunistas mediadas por cepas portantes de genes de resistencia a antibióticos.
Sobre la base de la revisión realizada, no se encontró diferencias importantes en la tasa de portación de Enterobacteriaceae entre orofaringe y cavidad oral, bordeando en ambos casos el 40% en promedio, independientemente de variables demográficas y clínicas. Este resultado es comparable con la estadística reportada por el estudio de Philpot et al [25], realizado en Malasia y publicado en los años ochenta. En el mismo, la portación oral de Enterobacteriaceae se informó en 36% para adultos y 46% para niños. Sin embargo, estudios que datan de los años setenta [21] y noventa [52], comunicaron tasas de colonización oral para enterobacterias menores al 20%. Estos datos sugieren un incremento en la prevalencia de portación oral de Enterobacteriaceae en los últimos veinte años.
Al comparar la epidemiología oral de Enterobacteriaceae con la reportada en otros sitios como mucosa rectal, se obtiene una diferencia cuantitativa más no cualitativa. En efecto, el estudio de Padilla et al, [53] reportó una prevalencia del 14,4% de enterobacterias en zona rectal, recayendo el mayor riesgo de colonización en sujetos con historia de intervención quirúrgica o en los expuestos previamente a antibióticos. Respecto al perfil de especies, el estudio de Padilla et al informó una alta tasa de aislamiento de Klebsiella pneumoniae, Enterobacter cloacae y Escherichia coli. Estos resultados concuerdan con nuestra revisión en que los taxones más frecuentes, tanto en las colonizaciones orales como orofaríngeas, fueron Enterobacter spp., Klebsiella spp y Escherichia coli. Este fenómeno le otorga un papel relevante a la transmisión oro-fecal en la colonización oral-rectal de Enterobacteriaceae.
Al considerar la influencia de variables demográficas en la tasa de portación oral de enterobacterias, se obtuvo que el grupo de infanto-adolescentes ostenta mayor probabilidad de estar colonizado respecto de sujetos adultos jóvenes y de mediana edad. Esta tendencia posiblemente está condicionada por la mayor prevalencia en infanto-adolescentes de hábitos parafuncionales como la onicofagia, así como de pobres hábitos de higiene [27]. No hay estudios que comparen la portación de enterobacterias en orofaringe entre distintos grupos etarios. La evidencia disponible demuestra que entre 38 y 40% de la población adulta mayor y senescente porta enterobacterias en dicho hábitat, contrastando con la frecuencia de portación informada en otros sitios. En efecto, se ha reportado una tasa de colonización rectal del 14,4% en la población adulta mayor [53]. Esta diferencia en la carga de enterobacterias entre recto y orofaringe en un grupo etario vulnerable vinculado a la inmunosenescencia, explica la alta frecuencia de neumonía que se ha informado en pacientes ancianos internados en geriátricos [54]. En este grupo poblacional se reconoce como factor de riesgo significativo para la portación orofaríngea de bacterias resistentes a antibióticos, como β-lactamasas de espectro extendido-Enterobacteriaceae y la historia personal de eventos cerebro-vasculares. Por otro lado, varios estudios demuestran la eficacia del cuidado oral profesional para reducir la morbilidad y mortalidad asociada a la neumonía adquirida en residencias de ancianos [54,55].
A nivel taxonómico, los grupos bacterianos de la familia Enterobacteriaceae que mostraron dominancia tanto en cavidad oral como en orofaringe fueron los géneros Enterobacter spp., Klebsiella spp., y Escherichia spp. Sin embargo, a nivel de especie, se encontraron ligeras discrepancias entre los dos hábitats, ya que Enterobacter cloacae fue la especie más prevalente en cavidad oral y en orofaringe fue Klebsiella pneumoniae. En ambos sitios se reporta la presencia secundaria de Escherichia coli y Enterobacter aerogenes. Este resultado probablemente explique la alta frecuencia de Klebsiella pneumoniae y Escherichia coli reportada por Tadesse S, et al, [56] a nivel de muestras clínicas de pacientes etíopes con sospecha de infección, tanto internados como ambulatorios. Un estudio realizado en Tanzania indica que Escherichia coli y Klebsiella pneumoniae son las especies de enterobacterias más prevalentes en muestras clínicas. Wilson y Gaido indican que Escherichia coli es la causa más frecuente de infecciones. También se informaron hallazgos similares en Bahrein [57].
Respecto al fenotipo de resistencia, la revisión realizada permitió establecer que para enterobacterias orales, el antibiótico menos activo fue la amoxicilina seguida de ampicilina. Por su parte, los betalactámicos asociados a inhibidores suicidas presentaron mejor rendimiento. Este patrón contrasta con el reporte de Goncalves et al, [30] quienes obtuvieron de nichos subgingivales en pacientes con periodontitis crónica, cepas de enterobacterias susceptibles a grupos de antibióticos como cefalosporinas, aztreonam, carbapenémicos, aminoglucósidos y fluorquinolonas. Estos datos sugieren que el perfil de respuesta a los antimicrobianos entre cepas de enterobacterias orales, posiblemente varía de un nicho a otro. Por ende, del análisis sobre la actividad antimicrobiana frente a enterobacterias procedentes de orofaringe, se obtuvo que el antibiótico menos activo para el total de especies aisladas fue la ampicilina seguido de las cefalosporinas. Los grupos de antibióticos que demostraron mejor rendimiento frente a especies como Escherichia coli, Klebsiella pneumoniae, Klebsiella aerogenes, Enterobacter cloacae, Raoultella planticola, Rahnella.sp., Serratia marcescens, y Morganella morganii fueron los carbapenémicos como imipenem y meropenem, aminoglucósidos, sulfametoxazol y betalactámicos asociados a inhibidores suicidas. Sobre la base del estudio de Le et al, el 100% de los aislados de Escherichia coli procedentes de orofaringe presentaron multidrogoresistencia, dado la portación de genes codificantes de β-lactamasas de espectro extendido como el grupo CTX-M9. Frente a estos aislados, las únicas drogas que demostraron eficiente actividad fueron los carbapenémicos (imipenem y meropenem) [36]. Los pacientes de los cuales se obtuvieron estas cepas con fenotipo de multidrogoresistencia, correspondían a sujetos seniles internados en casas de reposo de larga estancia. De hecho, muchos estudios asocian el riesgo de portación y diseminación de las enterobacterias productoras de β-lactamasas de espectro extendido con salas quirúrgicas, estancia hospitalaria prolongada, terapia inapropiada, uso de catéteres permanentes y enfermedades graves [58].
Sobre los factores que influyen en la colonización oral u orofaríngea de enterobacterias, se encontraron diferencias en función de la edad. En sujetos seniles, se reconocen como principales determinantes el deterioro funcional de los pacientes vinculado a estados terminales o enfermedad severa, alimentación a través de sonda, incontinencia vesical y enfermedad renal crónica en estado avanzado. Si comparamos estos resultados con evidencia más precoz, se encuentran concordancias. En este contexto, en la investigación de Samaranayake et al, publicado en 2004 [31], el 71% de los participantes tenían más de 50 años y usaban medicación antihipertensiva, antiglucemiante, psiquiátrica, cardiaca y antiácida. Estos datos sugieren que en sujetos de edad avanzada, la afectación sistémica sería uno de los principales contribuyentes para la adquisición y portación de Enterobacteriaceae en cavidad oral u orofaringe. Adicionalmente, nuestro consenso es comparable a lo reportado por Tada et al, [59] quienes reportaron una tasa de aislamiento del 16% de Enterobacter cloacae en las muestras de placa dental de personas que requirieron atención sistémica. Paralelo a esto, Tada y su grupo [59], informaron la existencia de asociación entre la colonización oral por patógenos oportunistas y la incidencia de neumonía en pacientes hospitalizados, encontrándose entre ellos Escherichia coli y Enterobacter cloacae en la placa dental de ocho pacientes.
En menores de 65 años, la presente revisión reconoció variedad de factores contribuyentes a la colonización oral u orofaríngea de Enterobacteriaceae, desde la portación oral de dispositivos, hábitos parafuncionales, tabaquismo, enfermedad periodontal e higiene oral deficiente. Asimismo, Pathak et al [32], encontraron que los dispositivos intraorales son uno de los principales factores que rigen el cambio de la compleja comunidad comensal de la cavidad bucal hacia la fuente de patógenos, al proporcionar un sitio adicional de adhesión y unión en forma de biopelículas, actuando como un reservorio bacteriano patógeno. Adicionalmente, el estudio de Pathak et al [32], detectó amplias variedades de bacterias asociadas con dispositivos de ortodoncia como miembros de la familia Enterobacteriaceae, bacterias anaeróbicas de los géneros Lactobacillus y Streptococcus, bacilos grampositivos del género Bacillus sp. y hongos del género Candida. En contraposición, en el estudio de Conti et al [38], no se pudo probar correlación entre la presencia de microorganismos y las prótesis orales. Este resultado puede estar relacionado con el pequeño número de usuarios de prótesis dentales en la muestra.
Según el estudio de Baydas et al [29], los hábitos parafuncionales como la onicofagia puede provocar la autoinoculación de patógenos y la transmisión de infecciones a otras partes del cuerpo, con mayor riesgo de transmisión de enterobacterias por vía fecal-oral en los sujetos que se muerden compulsivamente las uñas en comparación con los sujetos sin hábito. El estudio de Kamal y Bernard [28], concuerdan con lo descrito anteriormente. Ellos observaron que en los niños, la presencia de hábitos perniciosos como chuparse los dedos o morderse las uñas, acompañado de un mal mantenimiento de la higiene, podría resultar en condiciones sistémicas debilitantes. Ello debido a que estos hábitos asociados a higiene oral deficiente, darían paso a un mayor acumulo de placa dental, favoreciendo la colonización de numerosos microorganismos como es el caso de las enterobacterias. Entre ellas se destacan Escherichia coli, seguida por especies de Klebsiella, Proteus y Enterobacter, cuya diseminación a través de la cavidad bucal puede desembocar en infecciones locales y sistémicas [28]. Por otra parte, Tischendorf et al [60], informaron en su estudio que la enfermedad renal crónica involucra a importantes patógenos, capaces de mediar enfermedad en los pacientes que los portan. En este estudio se pudo encontrar 16,5% de infecciones en pacientes que se encontraban colonizados con enfermedad renal crónica. Dentro de esto, los hombres representaron entre el 33 y el 69%, siendo Klebsiella pneumoniae una de las enterobacterias más examinadas. Por esta razón, las infecciones por enfermedad renal crónica han sido asociadas a una tasa de mortalidad considerable de entre 30 y 75%. Otros factores como estancia hospitalaria prolongada, un peor estado de salud general, enfermedades comórbidas, y limitadas opciones antimicrobianas para tratar estas infecciones, también contribuyen a esta alta tasa de mortalidad [60].
En relación al impacto médico de la colonización asintomática por este grupo de organismos, se ha propuesto que las enterobacterias al ser patógenos oportunistas en pacientes con enfermedad renal crónica de estadio avanzado, pueden conducir a un aumento potencial de episodios infecciosos e inflamatorios resistentes en estos pacientes. Así, se contribuye a la progresión de la enfermedad renal. Según Costa et al [26], la acumulación de toxinas urémicas en pacientes con insuficiencia renal avanzada, y los consiguientes cambios en el ecosistema oral, pueden actuar como factores de selección en el microbioma bucal, llevando a una disbiosis con proliferación de patobiontes. Sobre esto último, estudios en modelos animales han demostrado que las cepas de Klebsiella pneumoniae con capacidad de colonizar eficientemente el tracto intestinal y diseminarse de forma robusta de un sitio a otro y de un hospedador a otro, son aquellas denominadas como “hipervirulentas”. Ello, a consecuencia de la expresión de cápsula [61] y multidrogoresistencia [43], ambos fenotipos vinculados con la portación de genomas accesorios en estas cepas patobiontes de Klebsiella pneumoniae [62]. Este genoma accesorio estaría conformado por plásmidos y loci génicos cromosomales, siendo el responsable de dividir a las cepas de Klebsiella pneumoniae en oportunistas, hipervirulentas y multidrogoresistentes. Las primeras serían capaces de causar enfermedad en pacientes críticos e inmunocomprometidos. Las segundas mediarían enfermedad en sujetos inmunocompetentes saludables. Y las terceras también se comportarían como oportunistas, pero causando infecciones difíciles de tratar. Por lo tanto, es este genoma accesorio el que determinará si una colonización aero-digestiva alta de Klebsiella pneumoniae, permanece asintomática o evoluciona hacia la enfermedad [62]. Adicionalmente, cepas patobiontes de Escherichia coli caracterizadas por poseer un fenotipo adherente e invasivo han sido relacionadas con el inicio y progresión de la enfermedad inflamatorio intestinal, por poseer factores estimuladores que disparan la activación del sistema inmune intestinal [63]. Tal es así, que una revisión sistemática con metaanálisis demostró un incremento sustancial en la prevalencia de estas cepas patobiontes de Escherichia coli en pacientes con enfermedad inflamatoria intestinal comparada con controles. Los resultados de este trabajo reportaron un Odds ratio de 2,82 para colitis ulcerativa y de 3,27 para enfermedad de Crohn [64]. De esta forma se atribuyó un rol patogénico a las cepas “adherentes e invasivas” de Escherichia coli en la enfermedad inflamatoria intestinal.
En torno al impacto odontológico que tendría la colonización oral asintomática de enterobacterales, diversos estudios demuestran la presencia de estas bacterias en proporciones mayores en bolsas periodontales de pacientes con periodontitis respecto de individuos periodontalmente sanos [30,40,41,42,65] . De acuerdo a las observaciones de Vieira et al [42], esta colonización subgingival de enterobacterias es independiente de la velocidad de avance de la enfermedad. Por el contrario, Botero et al [65] demostraron en el año 2007 la presencia de enterobacterias en nichos subgingivales de pacientes con periodontitis agresiva con una frecuencia significativamente más alta, respecto de sujetos con periodontitis crónica y periodontalmente sanos. Adicionalmente, evidencia fuerte ubicó a las Enterobacteriaceae como patógenos no clásicos vinculados con la patogénesis de la enfermedad periodontal, pudiendo promover la progresión de la misma. Esto, tras detectar por revisión sistemática niveles y prevalencia significativamente más alta de enterobacterias en pacientes con esta condición respecto de sujetos periodontalmente sanos. La presencia de enterobacterias sería especialmente importante en las formas agresivas de periodontitis [66]. En concordancia, una revisión del año 2014 sobre la microbiología periodontal de América Latina concluyó que los bacilos entéricos gramnegativos, al igual que los herpes virus, podrían ejercer un rol importante en la patogénesis de la enfermedad periodontal en población latinoamericana. En ella, la enfermedad periodontal severa es prevalente, fundamentalmente en grupos negros y mestizos. Esto está vinculado a factores como la pobreza, acceso limitado a los servicios para el cuidado de la salud incluyendo el cuidado periodontal [67]. Se requieren más estudios clínicos observacionales analíticos y longitudinales, además de preclínicos, para confirmar la contribución de los bacilos entéricos gramnegativos en la patogénesis de la enfermedad periodontal de rápido avance.
Recomendaciones
Ante los resultados de esta revisión bibliográfica, es importante que los profesionales de la salud oral indaguen, a través de una adecuada anamnesis sobre los determinantes de colonización aero-digestiva alta de enterobacterias. Ello, con el objeto de identificar potenciales portadores de este grupo bacteriano y fortalecer en ellos las medidas de higiene bucodental, higiene de manos y uso controlado de antibióticos. Estos son posibles factores a intervenir para evitar complicaciones sistémicas infecciosas e inflamatorias, a pesar de ser un tema poco abordado en el área odontológica.
Conclusiones
La presencia de Enterobacteriaceae en nichos no habituales como boca y orofaringe es significativa. Los géneros Enterobacter, Klebsiella y Escherichia son los grupos dominantes en ambos hábitats. Estos géneros estarían mayormente representados por cepas con susceptibilidad decrecida a antibióticos betalactámicos como amoxicilina y ampicilina.
Basándonos en la evidencia analizada en esta revisión, su presencia sería favorecida y amplificada por un entorno inflamatorio como el proporcionado por la enfermedad periodontal, además de otros factores o determinantes que varían según la edad.
Esta portación asintomática de enterobacterias en el tracto aerodigestivo alto prevalece en sujetos infanto-adolescentes. Además, tiene implicaciones sistémicas de naturaleza infecciosa e inflamatoria, solo en hospedadores genéticamente predispuestos, inmunológicamente comprometidos o con una disbiosis intestinal preexistente inducida por antibióticos.
A nivel odontológico, no es posible precisar aún el rol que tendrían las enterobacterias en la patogénesis de la enfermedad periodontal.

