Artículo de revisión
← vista completaPublicado el 8 de enero de 2025 | http://doi.org/10.5867/medwave.2025.01.2994
Aspectos genéticos y neurobiológicos de la psicosis en el trastorno neurocognitivo mayor
Genetic and neurobiological aspects of psychosis in major neurocognitive disorder
Resumen
Los síntomas psiquiátricos son frecuentes en los trastornos neurocognitivos o demencias. Los síntomas psicóticos, principalmente alucinaciones y delirios, pueden aparecer en hasta 50% de los casos, influyendo en la morbilidad y mortalidad. Algunos factores genéticos, neurobiológicos y ambientales están involucrados en su inicio. Se realizó una revisión narrativa de artículos primarios desarrollados en humanos, que analizaron las bases genéticas y neurobiológicas de la psicosis en demencias. Existen variantes genéticas de riesgo para la presentación de la psicosis en demencia. Su relación con variantes genéticas de riesgo para esquizofrenia, para demencia y para otros trastornos neurodegenerativos está en discusión. Estudios de genes candidatos han encontrado variantes genéticas asociadas a la psicosis en demencia en genes como COMT, SLC6A4, APOE, HTR2A y HTR2C. En tanto, estudios de asociación del genoma completo han hallado variantes de riesgo localizadas en ENPP6 y SUMF1. Los estudios epigenéticos son escasos, pero han encontrado diferencias en el metiloma de personas con demencia y psicosis. Por otro lado, se han descrito alteraciones de los sistemas de neurotransmisión colinérgicos, serotoninérgicos, dopaminérgicos y gabaérgicos, así como del balance excitatorio-inhibitorio. Desde el punto de vista anatómico y funcional, hay alteraciones en varias regiones, principalmente en el área frontal y otras zonas de procesamiento e integración sensorial. Finalmente, se describe la influencia de las alteraciones cognitivas en la génesis y mantención de los delirios. Asimismo, se discute el traslape fenomenológico con las confabulaciones. Existen múltiples factores genéticos, neurobiológicos, estructurales y cognitivos que influyen en la aparición de delirios y alucinaciones en personas con demencia. Se requiere mayor investigación para entender la fisiopatología de la psicosis en las demencias. Este abordaje puede apoyar a una comprensión de la psicosis como entidad transdiagnóstica.
Ideas clave
- Los síntomas psicóticos son frecuentes en los trastornos neurocognitivos, y se asocian a mayor comorbilidad y peor pronóstico. Su aparición temporal en el desarrollo de la demencia no es clara.
- En la génesis de síntomas psicóticos en los trastornos neurocognitivos participan múltiples factores biológicos.
- Los estudios de asociación por barrido genómico (GWAS) han encontrado variantes genéticas de riesgo en los genes ENPP6 y SUMF1, mientras que la investigación epigenética es incipiente.
- No existe evidencia consistente sobre la relación entre las bases genéticas de las psicosis crónicas y la psicosis en demencia.
- Entre los factores neurobiológicos existen alteraciones en distintos sistemas de neurotransmisión, así como cambios morfofuncionales cerebrales asociados al proceso de neurodegeneración, especialmente en las regiones prefrontales, frontoestriatales y límbicas.
Introducción
El trastorno neurocognitivo leve y el trastorno neurocognitivo mayor o demencia, presentan naturaleza crónica y suelen constituir un continuo [1]. La prevalencia de la demencia en personas mayores de 65 años se estima en 5%, mientras que oscila entre 20 y 40% en mayores de 85 años. En el mundo existen alrededor de 50 millones de personas afectadas, cifra que alcanzaría los 139 millones en 2050 [2]. La causa más frecuente de demencia es la enfermedad de Alzheimer (70% de los casos) [3], seguida por la demencia vascular, la demencia frontotemporal, la demencia asociada a enfermedad de Parkinson y la demencia por cuerpos de Lewy. Sin embargo, los indicadores epidemiológicos fluctúan según las muestras estudiadas y la edad de inicio [4]. Otros tipos de demencia son aquellas relacionadas con traumatismos craneoencefálicos, las demencias mixtas y demencias por causas poco frecuentes [4]. Sus manifestaciones clínicas son diversas, incluyendo alteraciones cognitivas y conductuales. No obstante, coexisten síntomas de muchas otras esferas, tales como los síntomas psicóticos. En este espectro sintomático, se incluyen fundamentalmente las alucinaciones y los delirios, cuyo contenido más frecuente en demencia es el de perjuicio, robo y falso reconocimiento. A diferencia de la mayoría de los cuadros puramente psiquiátricos, las demencias pueden presentar más frecuentemente alucinaciones visuales.
Los delirios se observan en alrededor del 65% de quienes sufren demencias, independientemente de la causa [5]. Los síntomas psicóticos son más frecuentes en la demencia con cuerpos de Lewy, seguida por la demencia asociada a enfermedad de Parkinson, demencia vascular y demencia frontotemporal [6]. Los portadores de trastornos siquiátricos, en particular del espectro psicótico, presentan más frecuentemente demencia y viceversa [7]. En enfermedad de Alzheimer, las manifestaciones psicóticas pueden evidenciarse hasta en 50% de los pacientes [8], asociándose con mayores alteraciones cognitivas, agresividad, depresión y mortalidad [9]. Específicamente, las alucinaciones visuales se describen en cerca de la mitad de los pacientes con enfermedad de Parkinson y en la mayoría de los pacientes con enfermedad de Lewy [10].
Los síntomas psicóticos pueden preceder al deterioro cognitivo en personas mayores, en quienes podría diagnosticarse un trastorno delirante o una esquizofrenia de inicio tardío. Este hecho complejiza el escenario clínico. La psicosis también podría presentarse en los trastornos neurocognitivos leves, que muchas veces son la antesala de la demencia [11]. De esta manera, aunque la evidencia es escasa, sugiere que la psicosis comórbida a los trastornos neurocognitivos leves constituye parte de un proceso neurodegenerativo único, apoyando una aproximación sindromática de la psicosis como parte de la demencia [12].
Las psicosis de inicio tardío podrían originarse por procesos neurodegenerativos distintos a las formas típicas de psicosis de inicio temprano. También podrían considerarse síntomas no-cognitivos de procesos neurodegenerativos [12]. Específicamente, los hallazgos histopatológicos observados en enfermedad de Alzheimer jugarían un rol, tales como los ovillos neurofibrilares y las placas neuríticas, así como también lesiones vasculares [13]. Esto quiere decir que la psicosis en enfermedad de Alzheimer puede estar mediada por diferentes mecanismos que confluyen en una vía común.
En cuanto a las bases genéticas de la psicosis en demencia, se sabe que la demencia tiene una heredabilidad cercana al 30% [14], y que las formas poligénicas son mucho más frecuentes que aquellas con herencia mendeliana. Esto implica que en la mayoría de los casos de demencia participan múltiples variantes genéticas de riesgo, con efecto aditivo y pequeño. En este sentido, si las distintas formas de demencia tienen un riesgo distinto de presentar sintomatología psicótica, podría plantearse que la arquitectura genética difiere entre trastornos neurocognitivos y que se asocia a un riesgo diferencial de presentar psicosis. El conocimiento de la composición genética de la demencia ha tenido avances gracias al desarrollo de grandes estudios de asociación por barrido genómico o de asociación del genoma completo (GWAS, por su sigla en inglés Genome-Wide Association Studies). En estos estudios se han encontrado distintos polimorfismos con significancia y se ha analizado su asociación con la arquitectura genética conocida de la psicosis.
En esta revisión describimos los principales hallazgos en cuanto a los factores genéticos y neurobiológicos relacionados con la psicosis en demencia, a partir de la evidencia provista por estudios primarios realizados en seres humanos. Inicialmente abordamos los estudios genéticos realizados en genes candidatos, y luego en estudios de asociación por barrido genómico. Luego, discutimos los principales aspectos neurobiológicos, incluyendo los sistemas de neurotransmisión colinérgico, serotoninérgico, dopaminérgico y glutamatérgico; así como los hallazgos morfofuncionales más replicados. Finalmente, describimos algunos modelos cognitivos propuestos para explicar la aparición de delirios de falso reconocimiento.
Evidencia genética
La enfermedad de Alzheimer presenta agregación familiar [15], con una heredabilidad estimada inicialmente en 61% [16], y luego precisada en un rango de 18 a 31% [14]. Este último estudio verificó los dos primeros loci significativos para psicosis en enfermedad de Alzheimer: ENPP6 y SUMF1, cuya función en la fisiopatología de la enfermedad no es conocida. El primero, ENPP6, se relaciona con el metabolismo de los oligodendrocitos, mientras que SUMF1 está involucrado en la fisiología lisosomal [14]. DeMichele-Sweet y Sweet [17] propusieron tres posibles modelos genéticos. En todos ellos la presencia de variantes genéticas vinculadas a psicosis situadas en genes como COMT (catecol-O-metiltransferasa), NRG1 (neurregulina-1) y CHRNA7 (receptor nicotínico α7 de acetilcolina), juegan un rol central. En el primero, estas variantes genéticas interaccionan con algunos polimorfismos asociados a la enfermedad de Alzheimer, como el alelo ε4 de APOE (apolipoproteína E). En el segundo, las variantes modifican el curso de otras enfermedades neurodegenerativas, finalizando en un fenotipo similar. En el último modelo, las variantes interaccionan con otras involucradas en enfermedades del neurodesarrollo, como la esquizofrenia, para concluir en un mismo fenotipo. En un estudio posterior publicado en 2018 [18], el mismo grupo de investigación analizó una nueva cohorte de 2876 personas con enfermedad de Alzheimer. Sus hallazgos fueron replicados en una segunda cohorte de 2194 personas con enfermedad de Alzheimer, con y sin psicosis. Todos los participantes fueron genotipificados utilizando un arreglo que incluyó polimorfismos de nucleótido único (SNPs), con significancia conocida para la enfermedad de Alzheimer con psicosis, y otros polimorfismos de nucleótido único asociados a riesgo de esquizofrenia (1574 polimorfismos de nucleótido único). Se concluyó que el fenotipo enfermedad de Alzheimer con psicosis tuvo una asociación genética inversa con el riesgo de presentar esquizofrenia, ya que los polimorfismos asociados con esquizofrenia tuvieron un rol protector para presentar psicosis en enfermedad de Alzheimer. Estos resultados fueron corroborados en ambas cohortes. Los autores argumentan que el riesgo poligénico de esquizofrenia sería compartido con trastornos como el autismo y el trastorno bipolar, que en sus características biológicas y clínicas difieren significativamente de las enfermedades neurodegenerativas como la enfermedad de Alzheimer. Señalan que algunas variantes de riesgo para esquizofrenia relacionadas con alteraciones del neurodesarrollo, podrían tener un rol protector en enfermedad de Alzheimer. En efecto, la activación de la microglía mediada por la actividad de ciertos receptores, podría ser deletéreo durante el neurodesarrollo al alterar la estructura sináptica, y con ello aumentar el riesgo de esquizofrenia. Sin embargo, sería beneficioso en el curso de una enfermedad neurodegenerativa, ya que se asociaría con la eliminación de péptido β-amiloide.
DeMichele-Sweet et al. (2018) [18] realizaron un metanálisis de los datos, sin encontrar polimorfismos con un nivel de asociación estadística significativo para un estudio por barrido genómico. No obstante, hubo tres SNPs que destacaron por tener las asociaciones de mayor magnitud: rs300215, rs6859958 y rs999581. Todos ellos se localizan en el locus RP11-541P9.3, cuya función es desconocida, pero debido a su ubicación, río arriba de CCNG1, podría modular su función [18]. CCNG1 codifica para la ciclina G1, proteína vinculada con la regulación del ciclo celular mediante su interacción con proteínas con actividad kinasa, es decir, capaces de fosforilar. Por lo tanto, podría involucrarse en la psicosis en enfermedad de Alzheimer, ya que el hallazgo de agregados de τ fosforilados es un fenómeno central en esta condición [9]. En un segundo estudio por barrido genómico publicado en 2021 [14], DeMichele-Sweet et al., encontraron una correlación genética inversa, pero no significativa entre psicosis en enfermedad de Alzheimer y esquizofrenia.
En otro sentido, algunos autores señalan que la enfermedad de Alzheimer compartiría cierto riesgo genético con la esquizofrenia. Tal como lo exhibió un estudio que comprobó que la puntuación de riesgo poligénico para esquizofrenia se asoció con la presencia de síntomas psicóticos en personas con enfermedad de Alzheimer, especialmente en el caso de los delirios [19]. Este riesgo podría estar dado por algunas variantes genéticas que se han asociado con mayor consistencia a la presencia de esquizofrenia. Ejemplo de ello es el genotipo SS para la posición polimórfica BalI (bialélica, con alelos G y S), ubicada en el gen que codifica el receptor D3 de dopamina (DRD3). Sin embargo, una investigación no encontró una asociación entre las distintas variantes de BalI y la presencia de síntomas psicóticos en portadores de Alzheimer [20].
La presencia de ovillos neurofibrilares se vincularía a síntomas psicóticos en enfermedad de Alzheimer. Por esta razón, el estudio del gen MAPT, que codifica para la proteína τ asociada a microtúbulo, ha adquirido relevancia. Creese et al. [21] publicaron en 2014 un análisis de los datos aportados por dos ensayos clínicos sobre el uso de memantina, verificando que el alelo H2 del haplotipo MAPT se asoció a un riesgo 5,4 veces de mayor gravedad de las alucinaciones. Esto incluso después de controlar, según severidad de la demencia, el uso de memantina y de antipsicóticos. Por su parte, el gen que codifica para el transportador de serotonina (SLC6A4) presenta la región promotora polimórfica 5HTTLPR, con alelos conocidos como “corto” (S) y “largo” (L). Ambos se han vinculado, diferencialmente, con una serie de condiciones neuropsiquiátricas, incluyendo las demencias. Particularmente, las demencias por cuerpos de Lewy y asociada a enfermedad de Parkinson, comparten algunas características clínicas y fisiopatológicas. En este sentido, un estudio comparó la sintomatología psicótica en 97 participantes con alguna de estas demencias con 90 participantes sanos [22]. Los resultados indicaron que el genotipo LL de 5-HTTLPR se asoció significativamente con el riesgo de delirios, pero no de alucinaciones. Asimismo, Borroni et al. [23] analizaron las implicancias de variantes de 5-HTTLPR en el riesgo de psicosis en enfermedad de Alzheimer, encontrando una asociación significativa. Sin embargo, a diferencia del grupo anterior, el riesgo se asoció con portar el alelo S de 5-HTTLPR. Este estudio también encontró que el alelo de alta actividad de la enzima catecol-O-metiltransferasa se vinculó con un riesgo incrementado de psicosis en enfermedad de Alzheimer. Es interesante señalar que, al combinar el efecto de las variantes en ambos genes, el riesgo aumentaba cinco veces en comparación con quienes no portaban las variantes. En esta muestra, el genotipo de apolipoproteína E no tuvo un impacto sobre el riesgo de psicosis. Scasselatti et al. [24] estudiaron diversos síntomas psicológicos en una cohorte italiana de 362 pacientes con enfermedad de Alzheimer. En su trabajo, encontraron que quienes no portaban el alelo ε4 de apolipoproteína E tenían un riesgo aumentado de presentar psicosis. Conjuntamente, concluyeron que los homocigotos CC para el polimorfismo de nucléotido único C677T (rs1801133) situado en el gen metilentetrahidrofolato reductasa (MTHFR), mostraron un riesgo aumentado de presentar delirios. Esta variante se ha relacionado con otros síndromes neuropsiquiátricos, como la esquizofrenia. Los autores no encontraron asociaciones significativas entre las variantes del gen catecol-O-metiltransferasa y el fenotipo. El estudio por barrido genómico de DeMichele-Sweet et al. (2021) encontró una vinculación significativa, aunque de bajo tamaño, entre el alelo ε4 de apolipoproteína E y la psicosis en enfermedad de Alzheimer [14].
En cuanto a los receptores de serotonina, los polimorfismos 102-T/C del receptor 2A de serotonina (5-HTR2A) y Cys23Ser del receptor 2C de serotonina (5-HTR2C), se han asociado significativamente con alucinaciones auditivas y visuales en personas con Alzheimer. Los alelos C102 en el primer polimorfismo y Ser23 en el segundo, conducen a una menor expresión de receptores de serotonina que solo se asociaría a síntomas psicóticos en un contexto más avanzado de la enfermedad. Esto es, una vez que el proceso de neurodegeneración es evidente [25].
Desde la perspectiva epigenética, Pishva et al. [26] condujeron un estudio de casos y controles en tejido cerebral post mortem, analizando tres regiones asociadas a psicosis: giro temporal superior, corteza entorrinal y corteza prefrontal. Mediante un análisis de asociación por barrido epigenómico completo en 29 cerebros de personas con enfermedad de Alzheimer con psicosis y 18 sin psicosis, encontraron diferencias en el metiloma de distintas regiones. Entre ellas, detectaron diferencias en el gen arsénico 3 metiltransferasa (AS3MT) asociado al desarrollo y diferenciación neuronal. A nivel clínico, algunas variantes se han vinculado al riesgo de esquizofrenia.
Evidencia neurobiológica
Sistemas de neurotransmisión
El sistema colinérgico presenta interneuronas que modulan la acción de neuronas gabaérgicas y glutamatérgicas en el hipocampo, la corteza prefrontal, parietal y occipital. Esta última tiene un rol asociativo en la visión. El núcleo basal de Meynert estaría atrofiado en portadores de enfermedad de Parkinson con alucinaciones visuales. Niveles reducidos de acetilcolina en áreas corticales pueden provocar que la información procesada de manera inconsciente, emerja de manera consciente como alucinaciones. Además, los fármacos anticolinérgicos pueden provocar alucinaciones visuales, mientras que ocurre lo opuesto con inhibidores de la colinesterasa, como rivastigmina [27]. En cuanto al sistema serotoninérgico, en personas con enfermedad de Parkinson y psicosis se ha encontrado atrofia de algunas de sus estructuras, como los núcleos del rafe [27]. Por su parte, se ha reportado que los agonistas del receptor serotoninérgico 5-HT2A, como la dietilamida de ácido lisérgico (LSD) o la psilocibina, producen síntomas psicóticos [28]. Contrariamente, la pimavanserina, agonista inverso o antagonista del receptor 5-HT2A (sin afinidad por receptores dopaminérgicos, histaminérgicos, muscarínicos o adrenérgicos), presenta efectos antipsicóticos específicos en la psicosis en demencia. Ello, mediante la disminución de la actividad de estos receptores, regulando el exceso de actividad serotoninérgica cortical, el déficit gabaérgico y disminuyendo la actividad glutamatérgica hacia el área tegmental ventral [29]. En la misma línea, personas con enfermedad de Parkinson con alucinaciones visuales tienen mayor expresión del receptor 5-HT2A en la vía visual ventral, la corteza prefrontal dorsolateral, orbitofrontal e ínsula, hecho que podría relacionarse con los síntomas psicóticos. En efecto, se ha documentado que una actividad excesiva del receptor 5-HT2A en la corteza visual puede llevar específicamente a alucinaciones visuales. Según la hipótesis dopaminérgica de la psicosis, la estimulación del receptor en la corteza prefrontal activa los receptores N-metil-D-aspartato (NMDA) ubicados en neuronas glutamatérgicas, activando las neuronas dopaminérgicas del área tegmental ventral y generando sintomatología psicótica [27]. Precisamente, las zonas más alteradas en los procesos neurodegenerativos coinciden con zonas donde existe mayor expresión de este receptor (lóbulos frontales, parietales, temporales, occipitales y corteza entorrinal). Esta vía cortico-límbica se altera a través de distintos mecanismos, dependiendo de qué neuronas se pierden o dañan. Esto determina distintos fenómenos que confluyen en vías comunes, tales como una disfunción de interneuronas GABA, una disponibilidad excesiva de serotonina, mayor expresión del receptor 5-HT2A por pérdida de terminales serotoninérgicas en corteza prefrontal y visual, exceso de actividad dopaminérgica estriatal, aumento de la expresión del receptor D2 e hiperactividad glutamatérgica, entre otros [29].
La hipótesis dopaminérgica en esquizofrenia indica que los delirios y las alucinaciones se provocan por una hiperactividad dopaminérgica mesolímbica [30]. Si bien existe evidencia indirecta de estudios de neuroimagen funcional, no está claro si esta teoría se aplica a la sintomatología psicótica observada en los trastornos neurocognitivos. Por otro lado, el exceso de dopamina estriatal en los receptores dopaminérgicos D2 y D3 se relaciona con el desarrollo de delirios. Asimismo, en muestras de pacientes post mortem con enfermedad de Alzheimer, se ha verificado una mayor densidad de receptor D3 en núcleo accumbens y una neurotransmisión dopaminérgica disminuida en amígdala [31]. También, la L-dopa, agonista dopaminérgico utilizado en el tratamiento de la enfermedad de Parkinson, puede provocar psicosis como efecto adverso [32]. En enfermedad de Alzheimer se ha encontrado evidencia de degeneración dopaminérgica en el área tegmental ventral, incluso previo a la acumulación de depósitos de péptido β-amiloide y muerte celular en hipocampo. La neurodegeneración es más precoz en el área tegmental ventral que en otros centros, como el locus coeruleus, posiblemente porque estas neuronas son más susceptibles a la muerte celular. De esta manera, la degeneración en vía mesolímbica o mesolímbico-cortical se relaciona con síntomas neuropsiquiátricos, tanto en enfermedad de Alzheimer como en enfermedad de Parkinson [33]. Por lo tanto, dependiendo de la causa de degeneración neuronal, puede existir una disfunción de neuronas gabaérgicas, del receptor de glutamato NMDA, regulación al alza de receptor D2 en estriado o del receptor 5HT2A, así como una denervación estriatal (provocando hipersensibilidad de receptores dopaminérgicos mesolímbicos y corticales). A través de cualquiera de estas vías, se llegaría a la generación de síntomas psicóticos [28,32,34].
El receptor serotoninérgico 5-HT2A está presente tanto en las células piramidales como en las gabaérgicas. Existe un balance excitatorio/inhibitorio en función de la duración de la activación de este receptor. En los procesos neurodegenerativos, al perderse la función de las interneuronas gabaérgicas, se desencadena una excitación excesiva que puede llevar a síntomas psicóticos [29]. Habría un desbalance entre el tono excitatorio cortical y mesolímbico, asociado a una hiperactivación de neuronas piramidales en el área visual y de la vía mesolímbica, causando delirios y alucinaciones [28]. En personas con enfermedad de Alzheimer, las placas amiloides aumentan la sensibilidad de los receptores de glutamato en neuronas gabaérgicas, llevando a sobreestimulación y degeneración neuronal gabaérgica. En fases más tardías, este fenómeno lleva a una hipofunción del receptor NMDA de glutamato. Desde la evidencia farmacológica, la memantina, fármaco utilizado en el manejo de la demencia, antagoniza el receptor NMDA, lo que busca inhibir sus efectos excitotóxicos. No obstante, puede producir síntomas psicóticos o empeorarlos [28].
Alteraciones observadas en estudios de neuroimagen estructural y funcional
Los síntomas psicóticos en las demencias se han asociado a neurodegeneración en regiones como la corteza dorsolateral frontal, parietal, el cingulado anterior y el estriado ventral. Esto puede vincularse a la presencia de placas amiloides, depósitos de proteína τ, alteraciones vasculares, inflamación crónica o estrés oxidativo. En el caso del lóbulo frontal, su disfunción provoca alteraciones en la percepción, hecho que contribuiría a la aparición de alucinaciones visuales [29]. También existiría hiperactividad de la red neuronal por defecto, principalmente en regiones frontoparietales. Así, las redes atencionales disfuncionales pueden llevar a que aparezcan falsas imágenes originadas desde preceptos previamente almacenados [35].
En el caso de la enfermedad de Parkinson, se ha encontrado disminución volumétrica de áreas de la vía visual dorsal, involucrada en el procesamiento visual y cognitivo, así como también una reducción del volumen hipocampal, lo que se relaciona con una alteración en la integración de la información de las redes visuales ventrales y dorsales. Según estudios de tomografía computarizada por emisión de fotón único (SPECT, Single Photon Emission Computed Tomography), también habría una menor conectividad entre el hipocampo y áreas occipitotemporales [35]. En una cohorte de cuatro años de pacientes con enfermedad de Parkinson, el subgrupo que tuvo alucinaciones de inicio temprano (n = 21) presentó mayor déficit visual, atrofia cortical parietal, occipital, frontal e hipocampal [36]. Una patología relacionada con la enfermedad de Parkinson es la enfermedad por cuerpos de Lewy. En esta condición existe mayor densidad de cuerpos de Lewy en zonas de procesamiento e integración visual y auditiva, tales como la corteza parietal, frontal y temporal, así como también en amígdala y la región parahipocampal. En el caso del lóbulo parietal, este está relacionado con la percepción y procesamiento de estímulos externos, contribuyendo al equilibrio entre dos grupos de redes neuronales relacionadas con la atención: las redes de procesamiento top-down y bottom-up [27]. También se ha encontrado un menor volumen de la sustancia gris en la zona occipital, occipitotemporal, frontal medial y parietal inferior. A nivel clínico, se han hallado más déficits en funciones ejecutivas, atención visual y memoria semántica [35]. Según estudios de tomografía por emisión de positrones, habría un menor metabolismo en el giro precentral, superior, frontal y parietal, involucrando corteza premotora ventral. Por último, se ha descrito una conectividad funcional reducida entre regiones corticales bilaterales [37].
En cuanto a la enfermedad de Alzheimer con psicosis, un estudio de tomografía por emisión de positrones en 23 personas con esta patología, reportó un aumento en el número de receptores estriatales D2 y D3 en quienes tuvieron síntomas psicóticos. Asimismo, habría una disminución de la unión a ligando de los receptores colinérgicos muscarínicos M1, M3, M4 y M5. Además, habría una actividad anticolinesterásica disminuida en la zona frontotemporal, mayor densidad de receptor muscarínico M2 en el giro orbitofrontal y la corteza temporal [31].
Otros hallazgos incluyen una mayor densidad de ovillos neurofribilares de proteína τ fosforilada en corteza frontal y líquido cefalorraquídeo [31], sumado a un menor flujo cerebral en giro angular derecho y lóbulo occipital derecho [38]. Se ha identificado un circuito cortico-subcortical que incluye el giro frontal y cingulado, asociado con las conductas complejas intencionales y motivadas, junto con otras funciones de orden superior como planificación y resolución de problemas. La desconexión entre este y otros circuitos neocorticales sería un factor relacionado con la psicosis en Alzheimer [38]. En el espectro clínico comprendido por pacientes con criterios de demencia frontotemporal y esclerosis lateral amiotrófica que, adicionalmente presentan síntomas psicóticos, se ha reportado una menor densidad de la sustancia gris en la corteza prefrontal, giro temporal superior bilateral y giro frontal inferior, comparado con aquellos sin psicosis [39].
Finalmente, una revisión sistemática conducida por Murdy-Rootes et al. [32], cuyo objetivo fue encontrar diferencias clínicas y estructurales en los delirios en pacientes con diagnósticos tales como trastorno afectivo bipolar, esquizofrenia, enfermedad de Alzheimer, enfermedad de Parkinson y demencia frontotemporal, describió que existirían alteraciones comunes. Entre estas destacan reducciones en la sustancia gris de la corteza prefrontal dorsolateral, hipocampo, ínsula, giro temporal superior y giro frontal medio.
Aspectos cognitivos de los delirios en los trastornos neurocognitivos
Los delirios pueden aparecer en personas mayores sin alteraciones cognitivas y sin otros diagnósticos psiquiátricos, lo cual plantea un problema nosológico. No está claro si podrían corresponder a síntomas no cognitivos de enfermedades neurodegenerativas, que se manifiestan previamente a las alteraciones cognitivas. Tampoco es claro si aumentan el riesgo de desarrollo de demencia [12].
Con respecto a la influencia de las alteraciones cognitivas en los delirios, a mayor déficit cognitivo hay mayor riesgo de delirios, sobre todo cuando estos tienen relación con la disfunción del lóbulo frontal. No obstante, se requiere una función cognitiva mínima conservada para poder elaborar delirios [40,41]. El tipo de alteraciones cognitivas y los cambios ambientales pueden influir en el contenido de los delirios. Por ejemplo, los problemas de memoria o desorientación pueden influir en la elaboración de delirios de robo o de no reconocimiento del hogar. Mientras que los cambios en la relación con los cuidadores, pueden promover el pensamiento paranoide al no reconocerlos como recuerdan que eran. En este sentido, hay autores que han considerado a los delirios como parte de los síntomas cognitivos de las demencias, en lugar de un fenómeno independiente [42]. Los delirios en personas con déficits cognitivos severos pueden traslaparse clínicamente con las confabulaciones. En todas las falsas narrativas habría una disfunción de zonas frontolímbicas, y una dificultad para evaluar la veracidad de la información recuperada. Cuando los pacientes aceptan falsas narrativas como reales, esta disfunción frontal involucra problemas en el automonitoreo mediado por regiones frontolímbicas mediales y orbitofrontales. La corteza prefrontal ventromedial participa en la recuperación de la narrativa con sentimiento de “correcto”, descartando una atribución a una falsa creencia, según monitorización de fuente y contexto temporal. Paralelamente, la corteza orbitofrontal sería la encargada de suprimir la interferencia de pensamientos, anticipaciones y remanentes de memorias irrelevantes. La disfunción de ambas zonas sería necesaria para que existan las confabulaciones [43]. Por otro lado, ha aumentado la evidencia de lateralización de delirios en personas mayores, hecho que se vincularía con su contenido. Por ejemplo, personas con disfunción del hemisferio izquierdo presentarían delirios con contenido persecutorio, mientras que la disfunción derecha presentaría mayormente delirios de falsos reconocimientos [40].
La teoría de dos factores intenta explicar la presencia de delirios en los trastornos neurocognitivos. Esta teoría señala que existe una alteración neuropsicológica que, inicialmente promueve el delirio (factor 1), y una segunda que interfiere con el proceso de evaluación de la idea (factor 2). De no existir esta última alteración, la idea delirante sería rechazada. El factor 1 sería variable dependiendo del delirio, en cambio el factor 2 sería común en todos los delirios y su base biológica sería la disfunción de la corteza prefrontal dorsolateral derecha. En el proceso de evaluación de una hipótesis se realizan pruebas para formulación, confirmación y desconfirmación. Según estudios de resonancia magnética funcional, en este proceso se activaría la corteza prefrontal dorsolateral de manera bilateral en un inicio. Sin embargo, si la retroalimentación contradice la hipótesis, se activaría mayormente la zona derecha [44]. Por ejemplo, en el delirio de Capgras, o creencia de que un familiar ha sido reemplazado por un impostor, se ha evidenciado una alteración en la respuesta autonómica a los rostros familiares por daño en la corteza prefrontal ventromedial (factor 1). Pero este daño por sí solo no es suficiente para provocar el delirio, puesto que tiene que coexistir con un daño en la corteza prefrontal dorsolateral derecha (factor 2), provocando una “desconexión” entre el lóbulo temporal (área que coordina procesamiento facial) y los circuitos límbicos asociados con estímulos personales y emocionales apropiados [44,45]. En el caso del delirio de Fregoli, o creencia de que hay gente conocida que sigue a la persona pero se encuentra “disfrazada”, el factor 1 podría corresponder a un daño temporo-occipital izquierdo, que provoca una hipersensibilidad del sistema de reconocimiento facial (“hiperfamiliaridad” a rostros desconocidos), mientras que el factor 2 sigue siendo el daño en la corteza prefrontal dorsolateral derecha [44,45,46]. En la Figura 1 se sintetizan los principales hallazgos genéticos, neurobiológicos y cognitivos relacionados con la psicosis en la demencia.
Principales factores genéticos, neurobiológicos y cognitivos involucrados en la sintomatología psicótica de la demencia.
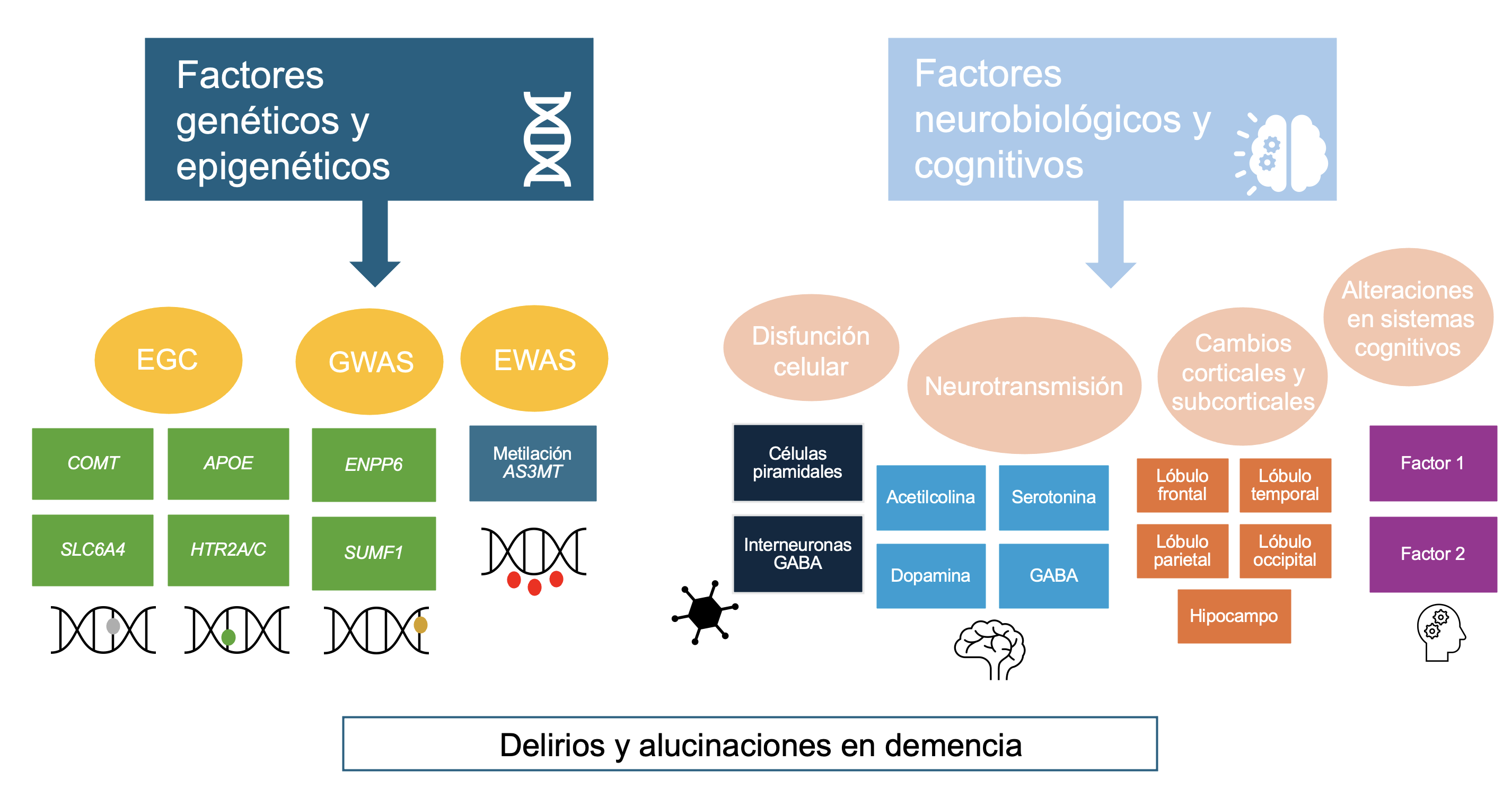
Fuente: elaboración propia a partir de los hallazgos de la revisión.
Conclusiones
La psicosis, cuyos síntomas cardinales son los delirios y las alucinaciones, es un fenómeno que se presenta fundamentalmente en cuadros como la esquizofrenia, aunque se ha observado frecuentemente en las demencias. La mayor parte de los estudios sobre psicosis en trastornos neurocognitivos se han realizado en muestras de personas con enfermedad de Alzheimer. Aunque clásicamente se ha considerado que la sintomatología psicótica aparece en estadios avanzados de la demencia, la evidencia ha demostrado que incluso puede preceder al inicio de la sintomatología cognitiva. En este sentido, la relación entre sintomatología cognitiva y psicótica es compleja e imbricada.
En la génesis de los síntomas psicóticos durante el curso de los trastornos neurocognitivos participan múltiples factores, incluyendo variantes genéticas de riesgo, disfunción de sistemas de neurotransmisión producto del proceso neurodegenerativo y cambios morfofuncionales cerebrales, especialmente prefrontales, frontoestriatales y límbicos.
El dilucidar las bases biológicas de la psicosis permitirá realizar cambios en la descripción clínica y la semiología de la demencia, otorgando eventualmente un diagnóstico más oportuno, de la mano de intervenciones terapéuticas especializadas y centradas en la persona. Esto, ya que si bien múltiples alteraciones biológicas pueden confluir en la misma sintomatología clínica, aquellas alteraciones biológicas podrían requerir de intervenciones distintas. Consideramos que estos aspectos son fundamentales en una patología que repercute profundamente en la calidad de vida de los pacientes y de su entorno, cuyo tratamiento es todavía muy limitado.

