Artículo de revisión
← vista completaPublicado el 20 de octubre de 2025 | http://doi.org/10.5867/medwave.2025.09.3026
Evidencia disponible de integración de COVID-19 a sistemas de vigilancia centinela: revisión de alcance
Available evidence on integrating COVID-19 into sentinel surveillance systems: A scoping review
Resumen
Introducción La pandemia de COVID-19 evidenció las debilidades de los sistemas de vigilancia epidemiológica y resaltó la necesidad de integrar nuevos virus respiratorios en los sistemas de vigilancia centinela. Sin embargo, la evidencia actual sobre su eficacia sigue siendo limitada.
Objetivo Este proyecto lleva a cabo una revisión del alcance para describir la evidencia disponible sobre el impacto de la integración del COVID-19 a los sistemas de vigilancia centinela.
Métodos Los estudios incluidos abordaron la vigilancia centinela en el contexto de la pandemia tras la declaración de la Organización Mundial de la Salud (OMS). Se realizó una búsqueda sistemática en bases de datos como MEDLINE/PubMed, LILACS, Epistemponikos y Dimensions. Se utilizaron estudios observacionales y revisiones sistemáticas. La recopilación y el análisis de datos se organizaron en categorías como características clínicas, detección oportuna, representatividad geográfica, coinfección y adaptabilidad con la vigilancia genómica. Se identificaron 17 estudios que informaron sobre el impacto de la integración de COVID-19 y un informe preliminar de la OMS.
Resultados Los resultados mostraron entre los síntomas más prevalentes en la población general: fiebre (73%), tos (51,8%), pérdida de gusto u olfato (45,1%), hipoxemia (33%), expectoración (23,9%). Se obtuvo una alta correlación entre los casos de infección respiratoria aguda grave (SARI) u hospitalizaciones por infección respiratoria y la incidencia de COVID-19 (ρ = 0,78 y ρ = 0,82 respectivamente).
Conclusiones La integración de COVID-19 al sistema de vigilancia centinela podría mejorar la capacidad de detección, respuesta y seguimiento. Asimismo. la utilización de definiciones de caso conduce a un uso más eficiente de pruebas de laboratorio que asegura la sostenibilidad del sistema de vigilancia
Ideas clave
- La revisión de alcance se centró en buscar la evidencia disponible de los sistemas de vigilancia centinela, donde se incluyen las características clínicas, detección oportuna y respuesta, representatividad geográfica, uso eficiente de recursos y adaptabilidad con vigilancia genómica.
- La integración de COVID-19 a los sistemas de vigilancia centinela de infecciones respiratorias agudas graves ha demostrado que podría tener un impacto favorable.
- A pesar de los beneficios observados, la evidencia disponible es limitada y heterogénea debido a las diferencias en los sistemas de vigilancia centinela de distintos países.
Introducción
El síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2), reportado por primera vez en Wuhan, China, a finales de 2019, provocó la pandemia de COVID-19, que impactó las actividades de vigilancia de infecciones respiratorias. Actualmente, muchos países están en transición del estado de emergencia, bajo las recomendaciones de organismos como la Organización Mundial de la Salud (OMS) y el Centro Europeo para la Prevención y el Control de Enfermedades (ECDC) [1]. La vigilancia centinela se basa en información de “unidades centinela”, que informan sobre una muestra predeterminada de individuos en los que se presenta el evento de interés [2]. La OMS recomienda definiciones de casos como infección respiratoria aguda (Acute Resparitory Infection, ARI), infección respiratoria aguda grave (Severe Acute Respiratory Infection, SARI) y enfermedad tipo influenza (Influenza-like Illness, ILI) [3]. Además, la información es importante en salud pública. Con los datos obtenidos se pueden guiar estrategias para limitar la propagación del SARS-CoV-2, así como reducir la morbilidad y mortalidad. La OMS sugiere mantener y reforzar la vigilancia centinela [4]. Finalmente, se han iniciado esfuerzos para evaluar las prioridades desde la perspectiva de los países, para identificar retos y brechas en la integración del COVID-19 en los sistemas de vigilancia de influenza y otros virus respiratorios [5].
En este contexto, la integración de COVID-19 en los sistemas de vigilancia centinela para infección respiratoria aguda grave representa una herramienta clave para una monitorización más eficiente frente a futuras amenazas pandémicas. Este proyecto tiene como propósito describir la evidencia disponible del impacto de la integración, analizar la capacidad de respuesta de los sistemas de vigilancia epidemiológica, el seguimiento de variantes del virus y la evaluación de intervenciones sanitarias.
Métodos
Esta revisión siguió las cinco etapas descritas en el marco de Arksey y O'Malley [6].
Fase 1: identificación de la pregunta de investigación
La siguiente pregunta dirigió esta revisión estructurada:
¿Cuál es la evidencia disponible del impacto de la integración del COVID-19 a los sistemas de vigilancia centinela en la gestión de COVID-19?
Fase 2: identificación de estudios pertinentes
Se realizó una búsqueda sistemática en las siguientes bases de datos MEDLINE/PubMed, LILACS, Epistemonikos y Dimensions. Esta última incorpora inteligencia artificial, que optimiza la recuperación de información mediante la aplicación de algoritmos de aprendizaje automático y procesamiento del lenguaje natural. La estrategia de búsqueda empleada en Dimensions fue: ("COVID-19" OR "coronavirus" OR "SARS-CoV-2") AND ("sentinel surveillance" OR " surveillance system " OR "sentinel networks” OR “sentinel surveillance system” OR “sentinel system” OR “sentinel surveillance system”) AND ("Universal Surveillance" OR "Mass Surveillance").
Tras la selección de los estudios, se llevó a cabo una revisión de las referencias bibliográficas de los artículos seleccionados. La búsqueda sistemática se limitó a publicaciones en inglés y español, y se enfocó en estudios publicados a partir del año 2019. Además, se incluyó la búsqueda de literatura gris en informes técnicos y operativos emitidos por organismos de salud pública, como la OMS, y por entidades gubernamentales. Se excluyeron estudios incompletos, artículos de opinión, revisiones narrativas, artículos que no incluyan el impacto de la integración de COVID-19 a los sistemas de vigilancia centinela y estudios realizados fuera del contexto temporal de la pandemia por SARS-CoV-2.
Fase 3: selección de estudios
Dos autores (JGS y JAI) revisaron de forma independiente los títulos y resúmenes. A continuación, revisaron los artículos relevantes en su totalidad. Se incluyeron aquellos artículos que describían la integración de COVID-19 en los sistemas de vigilancia centinela y los criterios de definición de caso, confirmados mediante la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR). Si los dos revisores no llegaban a un acuerdo sobre la inclusión del resumen o del artículo completo, se solicitaba la opinión de un tercer revisor (DPM).
Fase 4: proceso de elaboración de gráficos de datos
Dos revisores (JGS y DPM) desarrollaron la matriz estandarizada en Microsoft Excel ® (Anexo 1). Dos autores (JGS y JAI) realizaron de forma independiente la extracción de datos. Se recopiló información relacionada con datos generales (título, año de publicación, país) y datos metodológicos (diseño de la investigación, objetivo y resultados clínicos). Se aplicaron las herramientas de evaluación crítica del Joanna Briggs Institute (JBI) [7] para el análisis de la fiabilidad, la relevancia y los resultados de los artículos incluidos.
Fase 5: resumen de los resultados
Los resultados se organizaron en las siguientes categorías: características clínicas, detección oportuna y respuesta, representatividad geográfica, uso eficiente de recursos, coinfección y adaptabilidad con vigilancia genómica. La revisión se realizó de acuerdo con las directrices Preferred reporting items for a systematic review and meta‐analysis guidelines extension for scoping review (PRISMA-SCR) [8].
Resultados
Se identificaron 44 estudios que exploran la integración de COVID-19 en los sistemas de vigilancia centinela (Figura 1).
Diagrama de flujo según declaración PRISMA – ScR para la integración de COVID-19 a los sistemas de vigilancia centinela.
PRISMA-ScR:
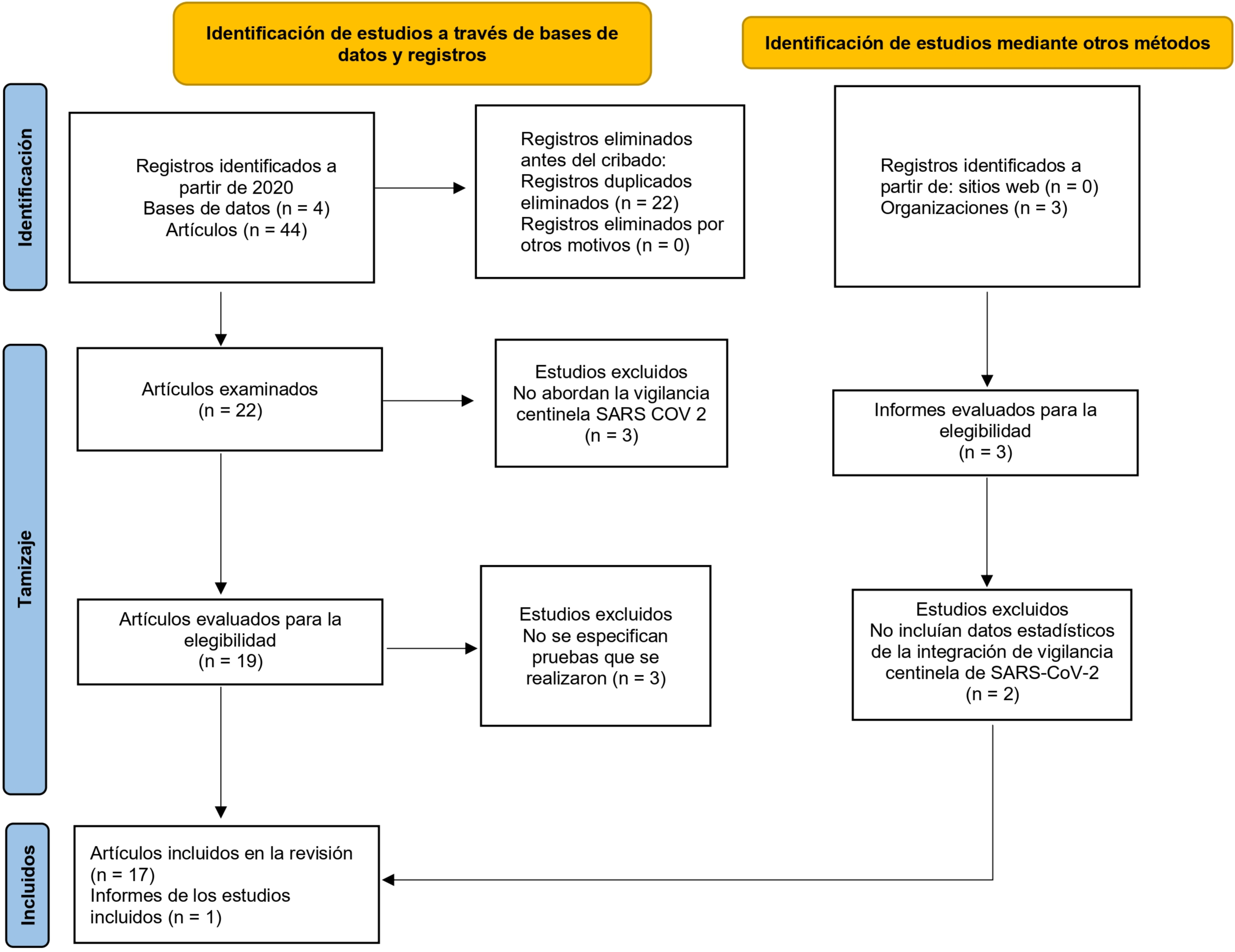
Los estudios incluidos fueron: 1 revisión sistemática y 16 estudios transversales provenientes de: Reino Unido [9], España [10,11,12], Bélgica [13], Kenia [14], China [15], Estados Unidos [16,17,18], Portugal [19], Egipto [20], Israel [21,22], Uganda [23], Níger [24], Bangladesh [25] y un informe de la OMS [26]. Los estudios reportaron datos entre el 30 de enero de 2020 y el 15 de diciembre de 2023 (Tabla 1).
Los datos de la evaluación crítica de las fuentes de evidencia incluidas se encuentran disponibles en:
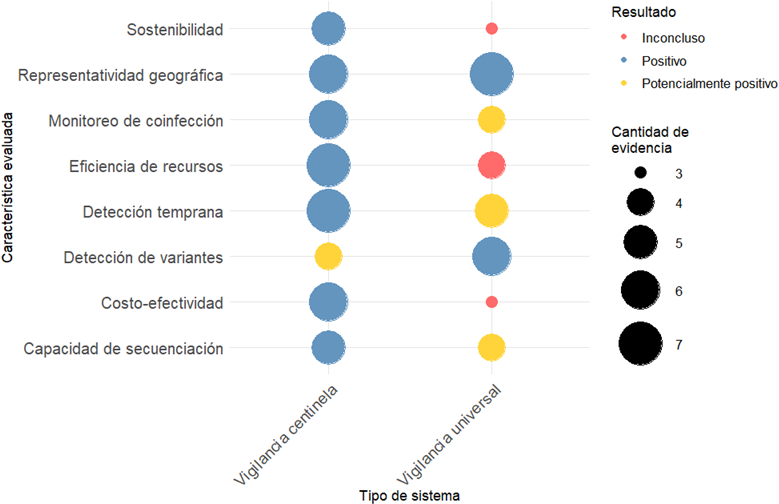
La vigilancia epidemiológica de COVID-19 ha representado un desafío global para los sistemas de salud, requiriendo enfoques adaptativos y eficientes para su monitoreo. Entre los sistemas implementados, la vigilancia centinela y la vigilancia universal han sido ampliamente discutidas en términos de su desempeño, sostenibilidad y capacidad para generar información relevante en contextos diversos. A partir de la evidencia disponible entre 2020 y 2023, se han evaluado ocho características fundamentales: sostenibilidad, representatividad geográfica, monitoreo de coinfección, eficiencia de recursos, detección temprana, detección de variantes, costo-efectividad y capacidad de secuenciación. Los resultados se clasifican en positivos, potencialmente positivos e inconclusos, mostrando además la cantidad de evidencia que respalda cada hallazgo (Figura 2).
Comparación de sistemas de vigilancia COVID-19. Vigilancia centinela versus universal basada en evidencia 2020 a 2023.
Características clínicas
La frecuencia de signos y síntomas constituye un elemento para la elaboración de una definición de caso en el marco de la vigilancia centinela. En este contexto, los resultados de tres estudios analizaron las características clínicas del COVID-19 en diferentes escenarios geográficos. Estos hallazgos resaltan a la fiebre y la tos como los síntomas más prevalentes, aunque se observan diferencias significativas según las características de la población y el entorno evaluado (Tabla 2).
También la OMS en su última publicación de la estrategia para la integración del COVID-19 mostró sensibilidad y especificidad sobre la base de las definiciones de caso utilizadas para la vigilancia de la influenza, donde se aprecian valores similares a la hora de comparar (Tabla 3).
Detección oportuna y respuesta
Estudios entre 2022 y 2023 han demostrado que la vigilancia centinela permite identificar de manera temprana los máximos epidémicos, circulación simultánea de patógenos respiratorios y tasas de positividad del SARS-CoV-2. Además, estos han proporcionado información esencial para la toma de decisiones en salud pública y el diseño de estrategias de control epidemiológico (Tabla 4).
Representatividad geográfica
Los sistemas de vigilancia requieren que las muestras sean representativas de la población general, como lo demuestra un estudio realizado en Washington, Estados Unidos, donde se analizó la extensión geográfica de los datos de secuenciación disponibles para casos de COVID-19 mediante un mapa de puntos calientes. Antes de la implementación de la vigilancia centinela, solo el 3,3% de los casos confirmados (10 653 de 323 121 casos totales) contaban con información de secuenciación disponible, lo que limitaba la representatividad de los datos geográficos. Sin embargo, durante el período en el que se aplicó la vigilancia centinela, este porcentaje aumentó al 12,1% (56 106 casos muestreados). Ello permitió una mayor cobertura y uniformidad en todos los condados. Estos resultados resaltan cómo la vigilancia centinela contribuye significativamente a mejorar la representatividad y la utilidad de los sistemas de monitoreo de enfermedades infecciosas.
Uso eficiente de los recursos
En tres estudios de España se observó que en la comunidad autónoma de La Rioja, la comparación entre los sistemas de vigilancia centinela y universal en el monitoreo de infecciones respiratorias agudas (IRA) evidencia que, si bien las tendencias generales muestran consistencia, el sistema de vigilancia centinela presenta variaciones. Por ejemplo, en menores de cuatro años, la vigilancia centinela alcanzó máximos de incidencia superiores (4958 casos por cada 100 000 habitantes, frente a 3691 en la vigilancia universal), mientras que en la semana 2 de 2022, reportó 3153,4 casos por cada 100 000 habitantes frente a 1773 en la vigilancia universal. Estas diferencias en la incidencia reflejan la capacidad de la vigilancia centinela para capturar patrones epidemiológicos. Esto permite optimizar recursos al reducir la necesidad de monitorear toda la población. En Castilla y León, se monitoreó a 62 000 personas (el 2,6% de la población total), mediante 68 unidades básicas de vigilancia distribuidas estratégicamente. Este enfoque permitió capturar tendencias epidemiológicas de manera eficiente, y disminuir costos operativos para asegurar la sostenibilidad del sistema de vigilancia.
Coinfección
La coinfección con SARS-CoV-2 y otros patógenos respiratorios como la influenza A, la influenza B y el virus sincicial respiratorio es un problema clínico/epidemiológico en África Oriental, como lo demuestran estudios realizados en Uganda y Kenia. Durante el periodo de estudio se detectaron un total de 22 casos de coinfecciones por centros de vigilancia enfermedad tipo influenza/infección respiratoria aguda grave: 2 casos con SARS-CoV-2/AH3; 9 casos con SARS-CoV-2/B-Victoria; y 11 casos con SARS-CoV-2/AH1pdm09. Por otro lado en Kenia, de un total de 1271 individuos, los patógenos coinfecciosos más comunes fueron Streptococcus pneumoniae (n = 29) y Haemophilus influenzae (n = 19), que representaron el 16,4 y el 10,7% de todas las muestras positivas para SARS-CoV-2.
Adaptabilidad con vigilancia genómica
La capacidad de detectar rápidamente nuevos patógenos es un indicador clave de la eficacia del sistema de vigilancia. Por ejemplo, un estudio realizado en Bélgica con 5695 muestras respiratorias, 1558 muestras dieron positivo para el SARS-CoV-2 y secuenciaron con éxito 925 muestras.
La vigilancia genómica inicial permitió evaluar la velocidad de crecimiento epidémico de variantes de SARS-CoV-2 mediante las pendientes de crecimiento en la fase epidémica. En estas, la más alta fue BA.1 (23,21), seguida de B.1.617.2 (Delta, 13,87), BA.5 (12,10) y BA.2 (10,91), mientras que P.1 (1,84) y BA.4 (1,92) tuvieron un crecimiento mucho más lento. Variantes como B.1.351 y BA.3 no mostraron crecimiento epidémico definido (R² indeterminado), y P.1 presentó un ajuste de regresión pobre (R² = 0,90). Aunque B.1.617.2 alcanzó una detección del 100% semanal, otras variantes tuvieron niveles máximos de detección variados, como BA.2 (98,5%), BA.1 (95,3%), y B.1.1.7 (85,1%), en contraste con BA.3 (0,14%) y B.1.351 (4,6%). El período entre la detección inicial y el crecimiento epidémico varió entre 2 y 8 semanas según la variante. Ello resalta la importancia de la vigilancia temprana para identificar variantes de rápida propagación.
En Israel la secuenciación del genoma, realizada en muestras centinela positivas para el SARS-CoV-2, proporcionó un apoyo adicional a esta misma vigilancia centinela. En Níger, de un total de 51 muestras positivas para SARS-CoV-2 identificadas a través del sistema de vigilancia centinela, 23 (45,1%) fueron elegibles para la secuenciación, con la identificación de dos sublinajes de Ómicron, en particular BA.5 y BA.3; 14 sublinajes XBB.1/XBB.1.5, y una variante recombinante XBD. El sublinaje XBB.1.5 es motivo de considerable preocupación debido a su rápida propagación en Estados Unidos, lo que evidencia la relevancia de la identificación y caracterización mediante la vigilancia genómica. Esta última demuestra capacidad para detectar sublinajes específicos y variantes recombinantes, lo que permite un monitoreo de su propagación y comportamiento.
Discusión
La revisión demuestra que la integración de COVID-19 en los sistemas de vigilancia centinela ha mejorado la capacidad para monitorear enfermedades respiratorias. También ha permitido la detección temprana de umbrales epidémicos y la identificación de coinfecciones [27,28]. En esta línea, podría ser una herramienta eficiente para optimizar recursos, especialmente en escenarios donde los sistemas de salud enfrentaron limitaciones económicas durante la pandemia de COVID-19. Esto fue particularmente relevante en algunos países, donde la redirección de recursos permitió mejorar la vigilancia de enfermedades respiratorias de alta incidencia [29].
La implementación de pruebas PCR multiplex ha permitido una mejor identificación de la coinfección entre SARS-CoV-2 y otros patógenos respiratorios. De igual forma, han sido útiles para monitorear la circulación simultánea de diferentes virus respiratorios [30,31].
Uno de los principales retos es la integración de la vigilancia genómica dentro de la vigilancia centinela. Más del 50% de los países ya realizan secuenciación genética, lo que ofrece una oportunidad rentable y sostenible para rastrear variantes del SARS-CoV-2 y fortalecer la respuesta ante futuras pandemias [32].
Las implicaciones económicas y operativas varían significativamente entre países según sus sistemas sanitarios y nivel de desarrollo. En países con sistemas de salud avanzados, como Israel y Portugal, la preexistencia de infraestructura tecnológica, personal especializado y sistemas digitales integrados de información sanitaria, facilitó la implementación simultánea de vigilancia centinela y genómica para COVID-19. Estos países lograron una alta sensibilidad en la detección de variantes y cambios epidemiológicos, como lo evidencian las correlaciones significativas reportadas en Portugal entre casos de infección respiratoria aguda grave y la incidencia de COVID-19. La capacidad de secuenciación genómica en estos entornos permitió caracterizar con precisión la diversidad viral circulante y detectar tempranamente variantes emergentes. Ello difiere de países con recursos limitados como Níger y Bangladesh, que enfrentaron desafíos significativos como infraestructura diagnóstica insuficiente, infraestructura de sistemas de información limitada y escasez de personal especializado. Estos países debieron adaptar sus estrategias mediante la priorización selectiva de centros centinela, reduciendo la cobertura geográfica, pero manteniendo la representatividad poblacional. En Níger, por ejemplo, solo el 45,1% de las muestras positivas para SARS-CoV-2 fueron elegibles para secuenciación, lo que podría resultar en una caracterización incompleta de la diversidad viral circulante. A pesar de estas limitaciones, lograron implementar sistemas funcionales que proporcionaron información epidemiológica valiosa para la toma de decisiones locales.
La heterogeneidad en los sistemas de vigilancia centinela entre países constituye una limitación metodológica importante para esta revisión. Las diferencias en las definiciones operativas de caso (enfermedad tipo influenza, infección respiratoria aguda e infección respiratoria aguda grave), los criterios de selección de sitios centinela, los protocolos de muestreo y los algoritmos diagnósticos empleados, dificultan la comparabilidad directa de resultados. Por ejemplo, mientras algunos países como España implementaron sistemas con alta representatividad geográfica (68 unidades básicas de vigilancia en Castilla y León), otros debieron concentrar recursos en áreas específicas. Asimismo, la variabilidad en la capacidad de secuenciación genómica (desde menos del 50% en países de bajos recursos hasta cerca del 80% en países desarrollados) genera asimetrías en la detección y caracterización de variantes. Futuros estudios deberían desarrollar marcos estandarizados para evaluar sistemas de vigilancia que contemplen explícitamente estas diferencias contextuales, permitiendo comparaciones más robustas entre entornos diversos.
Conclusión
Finalmente, las orientaciones provisionales de la OMS sobre la integración de la vigilancia de SARS-CoV-2 e influenza subrayan la necesidad de sistemas de vigilancia flexibles, con un fuerte apoyo gubernamental y el uso de la infraestructura de salud existente. Esto, con el objeto de garantizar una respuesta efectiva a futuras amenazas sanitarias [26].

